什么是色谱图?
色谱图表示发生在高效液相色谱系统中的化学[色谱]分离。一系列从基线出现的峰以时间为坐标。每个峰代表对不同化合物的检测器反应。色谱图由计算机数据站描绘。[如图 H].

Figure H: How Peaks Are Created
图H中,黄色谱带完全通过了检测器流通池;产生的电信号被送到计算机数据站。得到的色谱图逐渐出现在屏幕上。请注意从进样开始,色谱图就在屏幕底部形成直线。这条直线称为基线,它代表随时间变化,纯流动相通过流通池。随着黄色分析物谱带穿过流通池,一个较强信号被传送到计算机。这条曲线,开始是上升,之后下降,和样品谱带中的黄色染料的浓度成正比。这就形成了色谱峰。当黄色谱带完全流出检测器的流通池,信号强度回到基线水平,而流通池现在又一次,只有流动相。由于黄色谱带流动最快,首先从色谱柱洗脱出来,所以这是第一个峰。之后,一个红色谱带到达流通池。从红色谱带进入流通池开始,信号从基线抬起来,代表红色谱带的色谱峰被划出来。在本图中,红色谱带还没有完全通过流通池。图中所示是如果我们此刻停止该过程,红色谱带和红色色谱峰的样子。由于红色谱带的大部分已经通过了流通池,色谱峰的大部分已经被划出来,如实线所示。如果我们能再开始,红色谱带能完全通过流通池[虚线]。最强保留的蓝色谱带流速最低,在红色谱带之后流出。虚线表示如果我们连续完成,一个完整的色谱图如何出现。有意思的是蓝色峰的宽度将是最宽的,而蓝色分析物谱带的宽度在柱子上、是最窄的,而从柱中流出时变得最宽。这是因为它在色谱柱填料床中移动较慢,需要较多时间[和流动相体积]才被完全洗脱出来。由于流动相在一个固定的速度下移动,这意味着蓝色谱带展宽和变稀。由于检测器的反应与谱带的浓度成正比,因此蓝色峰高较低,而宽度较大。
定性和定量化合物
图H中,三个时间上分开的色谱峰代表三个染料化合物。每一个洗脱物在一个特定的位置,时间段计算从进样[零时]到峰最高点洗脱出来为止。比较每个峰的保留时间[tR]和注入同一色谱系统的标准物质[相同流动相和固定相]的保留时间,色谱工作者就可能鉴定每一个化合物。
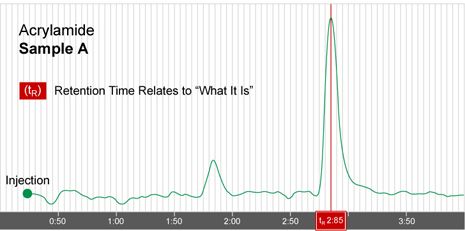
图 I -1 中出示的色谱图,色谱学家已经知道,在设定的液相条件下,分析物丙烯酰胺可以被分离并在2.85分钟[保留时间]从柱中洗脱下来。当任何一个新样品含有丙烯酰胺时,在相同的液相条件下,都会在2.85分钟出现色谱峰[如图 I -2 种样品 B]。当鉴定完成后,下一个重要的信息是样品中每一个化合物的含量是多少。来自检测器的色谱图和相应数据帮助我们计算每种化合物的浓度。检测器基本上反映化合物谱带通过流通池的浓度。浓度越高,信号越强,这可从基线上色谱峰高度观察到。
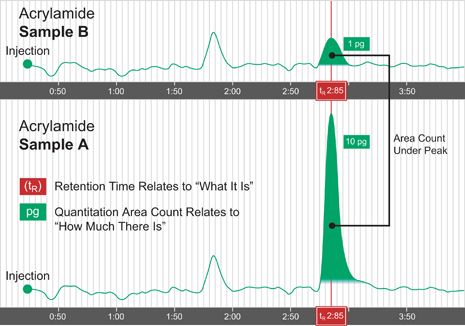
Figure I-2: Identification and Quantitation
图 I-2中,样品A和B的色谱图,在同一时间段相互重叠。两个样品的进样体积是一样的。两张色谱图在保留时间[tR] 2.85 分钟时都出现了一个色谱峰,表明每个样品都含有丙烯酰胺。然而,样品A显示出一个明显变大的丙烯酰胺峰。峰下面的面积[峰面积计算]是测量化合物浓度的一种方法。峰面积数值是由计算机数据站自动积分和计算。在这个例子中,样品A中丙烯酰胺的峰面积是样品 B 中的十倍。利用标准样品对比,可以推断样品 A 含有 10 pg 丙烯酰胺,是样品 B 中丙烯酰胺含量的十倍[1 pg]。注意另外一个峰[没有鉴定] 在两个样品中的洗脱时间都是 1.8 分钟。由于峰面积在两个样品中大致相同,因此这个未知化合物可能在两个样品中含量相同。
等度和梯度液相系统操作
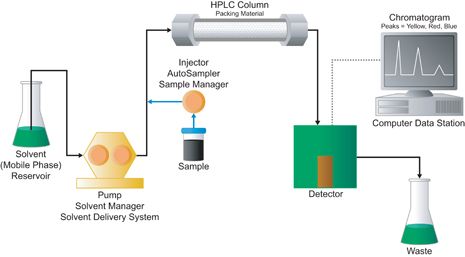
高效液相色谱使用两种基本的洗脱模式。第一种称为等度洗脱。在这种模式下,流动相,无论是纯溶剂或混合物,在整个操作过程中保持不变。一个典型的系统如图J-1所示。
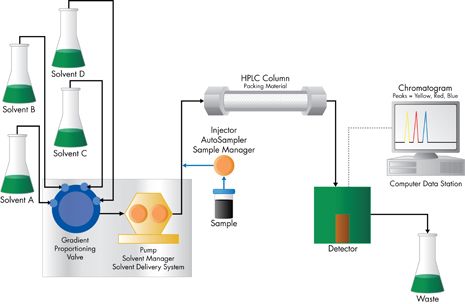
第二种称为梯度洗脱,正如名称所指,流动相的组成在分离过程中发生变化。这种模式对含有多种不同色谱极性化合物的样品非常有用[参见"高效液相色谱分离模式"]。随着分离的进行,流动相的洗脱强度逐渐增强以洗脱出更强保留的样品组分。

最简单的一个例子,如图 J-2 所示,有两个溶剂瓶和两个泵。每个泵的流速由梯度控制器管理,在分离过程中传输或多或少的溶剂。两种溶剂在混合器中混匀形成实际流动相,再传输到色谱柱上。起始阶段,流动相含有大比例的弱溶剂[溶剂 A]。一段时间以后,强溶剂[溶剂 B]的比例增加。注意图 J-2中,混合器是两个泵的下游,因此,梯度是在高压下产生的。另一种高效液相色谱系统可设计为在泵前低压条件下混合多种溶剂。一个梯度比例阀从四个溶剂瓶之间选择溶剂,随时间改变流动相强度[如图 J -3]。
高效液相色谱量级 [分析,制备和工程]
我们已经讨论了高效液相色谱如何提供分析数据,用于定性和定量样品中的化合物。然而,高效液相色谱也可以用来纯化和收集所需的每一个化合物,在流通池下游使用组分收集器。这个过程被称为制备液相[如图 K].

在制备液相中,科学家可以收集每个流出色谱柱的组分[例如:在本例中,黄色,之后红色,之后蓝色]。图 K: 高效液相色谱系统用于纯化:制备色谱法馏分收集器在特定的时间段,选择收集纯化了的组分。收集瓶可移动,从而使每瓶只收集单个峰的组分。科学家确定纯化的程度和数量的目标。结合样品的复杂性,所需组分相对基质的性质和相浓度等考虑,这些目标,又决定了需要处理的样品量和高效液相色谱系统的处理量。总的来说,随着样品量的增加,高效液相色谱柱尺寸将会加大,泵也会需要更高的体积流速。决定一个高效液相色谱系统的处理量称为选择高效液相色谱的量级。 表 A 列出各种高效液相色谱的量级及其色谱分离目标。

通过特定地匹配HPLC的固定相和流动相来最大化选择性-即获得两组分的最大分离度-在决定一个分离过程所需时很关键[参考"讨论高效液相色谱分离模式"]。容量成为衡量匹配上样量的柱体积[Vc]和选择适当颗粒[决定压力和效率,参考分离能力的讨论]的关键。柱体积,填料床长度[L]和内径[i.d.],决定填料多少。(如图 L).
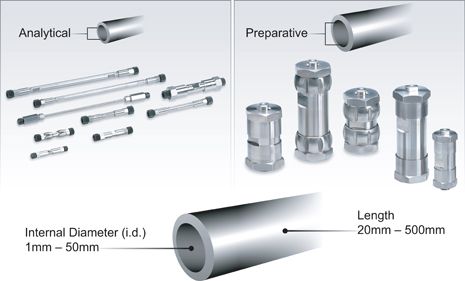
Figure L: HPLC Column Dimensions
总的来说,高效液相色谱柱长度[L]在 20 毫米到500 毫米之间,内径[i.d.]在 1 毫米到100 毫米之间。随着色谱量级的增加,柱尺寸增加,横截面积增加。为了优化通量,流动相流速必须与横截面积成比例增加。如果较小的颗粒要获得更强分离能力,泵必须设计成能承受更高反压下的更高流动相体积、流速。表 B 列出一些简单的挑选准则,为每种色谱量级推荐的色谱柱直径和颗粒尺寸范围。
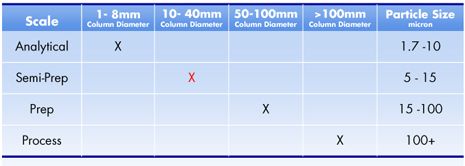
例如,半制备级液相[红色 X]可以用内径10 -40 毫米装 5 -15 微米的颗粒。柱长度可根据需要纯化的化合物的量和要求分离的程度计算出来。当你放大分离处理量时,沃特世制备计算器软件 CD 可以帮你恰当地选择色谱柱和设定其他操作参数,如流速。
高效液相色谱柱硬件
一个色谱柱管路和配件必须填有决定分离效果的色谱柱填料[固定相]。它必须能够承受生产过程和使用中的反压。而且,它必须是样品入口和分离的谱带出口控制良好[无泄漏,最小体积和零死体积]的流路,而且相对于分离系统[样品,流动相和固定相]来说具有化学惰性。为承受尽可能高的压力,大多数色谱柱由不锈钢制成。当分析特殊化学品或生物制品需要惰性表面材料时,也可能会用到尽管只能承受较小压力的 PEEKTM [一种工程塑料] 和玻璃[图 M-1]。

玻璃制色谱柱壁有视觉优势。在图 M - 2 的照片中,当样品谱带还在色谱柱中,传输被停止。你可以看到样品混合物中的三种染料已经在床层中分开,黄色分析物移动最快,将要流出色谱柱。
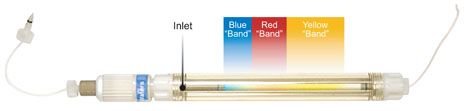
图 M-2: 色谱柱内部
分离性能 - 分离度
两种化合物分离的程度称为色谱分离度[RS]。 由色谱柱决定的总体分离能力或分离度的两个主要的因素是,机械分离能力:由色谱柱长度,粒径和填料床层的均一性决定,和化学分离能力:由填料和流动相对化合物的物化竞争决定。效率是衡量机械分离能力的指标,选择性是化学分离能力的指标。
机械分离能力 - 效率
如果色谱柱床稳定均一地填充,它的分离能力就由柱长度和颗粒大小决定。机械分离能力,也叫效率,通常以塔板数[符号是N]来测量和比较。较小颗粒色谱床有较高效率和反压。对于固定的颗粒大小,增加色谱柱长度可获得更强的机械分离能力。然而,代价是色谱运行时间延长,更多溶剂消耗和更高反压。减少色谱柱长度可以减小以上变量但也降低了机械分离能力,如图 N 所示。
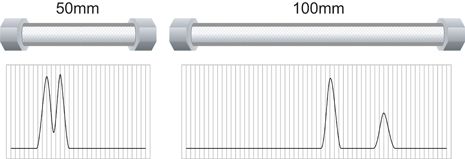
图 N: 色谱柱长度和机械分离能力 [相同颗粒尺寸]

图 O: 粒径和机械分离能力 [相同色谱柱长度]
化学分离能力 - 选择性
选择一种颗粒化学[固定相]和流动相的组合--分离系统--将决定化学分离能力[我们改变每一种分析物的速度的方法]的程度。优化选择性是创造分离最强有力的方式,这样可避免对最高机械效率的无尽追求。要产生对任何两种化合物的分离,科学家需在多种条件的相组合[固定相和流动相]中和保留机制[色谱模式]中选择。
高效液相色谱分离模式
总的来说,化合物的三种主要的性质可以用来产生高效液相色谱分离。它们是:
· 极性
· 电荷
· 分子大小
首先,让我们考虑极性和根据这一特性的两种主要分离模式:正相和反相色谱。
基于极性的分离
一个分子的结构、活性和物化性质由组成它的原子和化学键决定。在一个分子内部,决定了其特殊性质和可预测的化学反应的某些原子的特定排列,称为官能团。这个结构经常决定这个分子是极性还是非极性。有机分子根据它含有的主要官能团来分类。使用基于极性的分离模式,不同分子的相对色谱保留时间大都由这些官能团的本性和位置决定。如图 P 所示,不同类的分子可按照它们相对保留时间排列,形成从强色谱极性到强非极性的谱图。
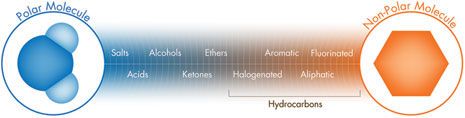
图 P:分析物官能团的色谱极性图
水[带有强偶极矩的小分子]是极性化合物。苯[一个芳香族碳水化合物]是非极性化合物。具有相似色谱极性的分子相互吸引,如果极性不同相互的吸引力会减弱,极端的情况是相互排斥。这是基于极性的色谱分离模式的基本原理。另外一种方式来思考是以此类推:油[非极性]和水[极性]不相容。不像磁体是异性相吸,基于极性的色谱分离是根据相似物的相互吸引和不同物质的相互排斥。记住在基于极性的色谱中相似物相互吸引。

图 Q: 适当流动相和固定相的组合影响基于极性的分离
设计一套色谱分离系统[如图Q],我们通过选择流动相和固定相制造样品中各种化合物的竞争。这样,样品中和固定相[柱填料]极性相似的化合物将被延迟因为它们更强地被颗粒吸引。而和流动相极性相似的化合物将优先被吸引而移动较快。[ 基于极性的分离 ]极性分子非极性分子这样,基于流动相和固定相对不同化合物的相对吸引力不同,改变分析物速度就产生了分离。图 R-1, R-2 和 R-3 分别列出了流动相,固定相和样品分析物的典型色谱极性范围。我们看看每一种情况,色谱学家如何选择适当的流动相和固定相以形成吸附竞争,获得基于极性的高效液相色谱分离。

图 R-1: 流动相色谱极性谱图
一个坐标上,如图R-1,一些常用的溶剂按相对色谱极性形成的排列,称为洗脱顺序。与分析物有效竞争固定相的流动相分子,替换分析物,使得分析物在色谱柱中加速移动[弱保留]。水在流动相坐标的极性端,而己烷,一种脂肪族烃类化合物在非极性端。在两者之间,单一溶剂以及易混合的溶剂混合物[按比例混合以满足特殊要求],可以按洗脱强度顺序排列。最强流动相端的位置与分析物发生竞争的固定相表面性质有关。

图 R-2: 固定相颗粒色谱极性图
硅胶具有活性,亲水性表面,含酸性硅烷醇[含硅胶的乙醇同原物]官能团。因此,它在固定相的极性端,如图 R-2 所示。硅胶表面的活性或极性可与弱极性官能团相结合的化学键选择性地修饰。这里所举的例子是为了降低极性,氰基[CN],正辛基[C8],十八烷基[C18,ODS]与部分硅胶结合。后者是疏水性[憎水的]的,极强非极性填充方式。

图 R-3: 化合物/分析物色谱极性图
图 R-3 重复了我们样品的色谱极性图[如图 P]。考虑到流动相和固定相的极性,对于某一固定相,色谱学家必须选择一个流动相,使得感兴趣的分析物可以结合在色谱柱上,但不能太强而洗脱不下来。在具有类似极性强度的溶剂中,色谱学家考虑固定相和流动相的配合,可以区分分析物极性和溶解性的更微弱的差别,使色谱系统的选择性最大化。同性相吸,但从目前的讨论可以想象,基于极性的分离是涉及到对样品的理解和各种分析物及保留模式的经验。总而言之,色谱学家会选择最佳的具有合适相反相极性的流动相合固定相的组合。之后,当样品流过色谱柱的时候,同性相吸的原则将决定哪一种分析物流速放缓,哪一种流速更快。
正相高效液相色谱
在植物提取物的分离过程中,茨维特成功运用极性固定相[玻璃柱中的粉笔末; 如图A]和弱极性[非极性]流动相。这种经典的色谱模式被称为正相。

图 S -1: 正相色谱法
图 S -1 代表三个染料混合物的正相色谱分离。极性的固定相最强地保留了极性的黄色染料。相对非极性的蓝色染料在非极性溶剂的流动相保留竞争中胜出,很快被洗脱出来。由于蓝色染料最像流动相[两者都是非极性],它流动得更快。对硅胶柱正相色谱来说,典型的情况流动相是100% 有机相,不含水。
反相高效液相色谱
反相是指与正相恰好相反的色谱模式,即使用极性流动相和非极性[疏水性]固定相。图 S-2 描述了三种染料的黑色混合物被该种方法分离的过程。
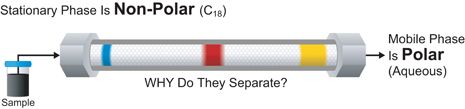
图 S-2: 反相色谱法
现在最强保留的化合物是非极性较强的蓝色染料,因为它与非极性的固定相吸附最强。极性的黄色染料,较弱保留,在极性水性流动相的竞争中胜出,流过填料床最快,最早被洗脱出来--正是同性相吸。今天,由于其更好的重现性和更广泛的应用,反相色谱占所有高效液相色谱方法的75%。大多数方法使用水和极性溶剂的混合物,如乙腈或甲醇。这样一般来说能保证分析物与非极性,疏水性颗粒表面的适当相互作用。C18合硅胶[有时称为ODS]是最普遍的反相高效液相色谱柱填料。图 S-2: 反相色谱法[ 反相高效液相色谱 ]表C给出基于极性分离的两种主要高效液相色谱的固定相和流动相特性的总结。记住,基于极性的模式,同性相吸。

表 C: 基于液相分离的两相特性
亲水作用色谱[HILIC]
亲水作用色谱[HILIC]可以看作是正相色谱的一种变化。正相色谱中,流动相是百分之百有机相。只有痕量水分存在于流动相和极性填料的空隙里。极性分析物与极性固定相较强吸附,不会被洗脱下来。在有机流动相[典型的是具有质子惰性的溶剂,如乙腈]中加入一些水分[<20%],就可能分离和洗脱在正相模式下强保留[或反相模式下弱保留]的极性化合物。水是强极性溶剂,和极性分析物有效竞争固定相。亲水作用色谱HILIC 可以在等度或梯度洗脱模式下运行。随着流动相极性[强度]的增加[加入更多水],最初吸附在极性填料颗粒的极性化合物可以被洗脱下来。分析物按照亲水性[相对水的色谱极性]由低至高的顺序被洗脱出来。缓冲液或盐可加至流动相中以保持离子化的分析物呈单一形式。
疏水作用色谱[HIC]
疏水作用色谱[HIC]是一种反相色谱用来分离大的生物分子,如蛋白。这些分子通常为保持原形而置于水溶液中,避免和会使其变性的有机溶剂或表面接触。HIC 通过疏水性固定相来达到大分子疏水目的,例如,是C4硅胶柱而不是C18硅胶柱。起始阶段,水中高盐浓度将帮助填料保留[盐析]蛋白。梯度分离经常是通过递减盐浓度来进行。这样,生物分子按照疏水性由低到高被洗脱出来。
基于电荷的分离: 离子交换色谱[IEC]
基于极性的分离,同性相吸,异性相斥。基于电荷的离子交换色谱和其他分离方式,规则是相反的,同性相斥,异性相吸。离子交换分离的固定相以表面酸碱性强弱和吸附保留的离子类型来划分。阳离子交换是用负电荷表面来保留和分离带正电荷的离子。反之亦然,阴离子交换是用正电荷表面来保留和分离带负电荷的离子[如图 T ]。每一种离子交换类型,都至少有两种分离和洗脱方法。
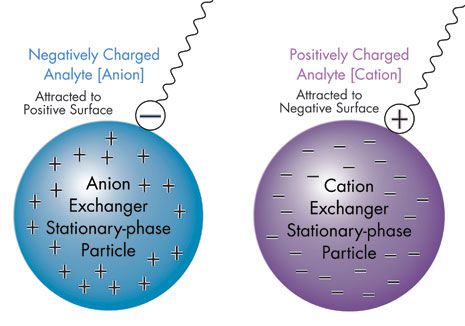
图 T: 离子交换色谱法
强离子交换体系具有易离子化的官能团[即,季胺类或磺酸类]。它们主要用于保留和分离弱离子。这些弱离子可被含有可更强吸附在固定相表面的离子的流动相洗脱或代替。或者,弱离子可以被保留在柱上,之后通过原位改变流动相的pH值被中和,使其失去吸附力而被洗脱。弱离子交换体系[如,二胺类或羧酸类]可能在某个pH值以上或以下被中和而失去保留带电离子的能力。当携带电荷时,它们用来保留和分离强离子。如果这些离子不能被替代物洗脱,固定相交换点可能被中和而切断离子化吸附,使得带电分析物被洗脱下来。
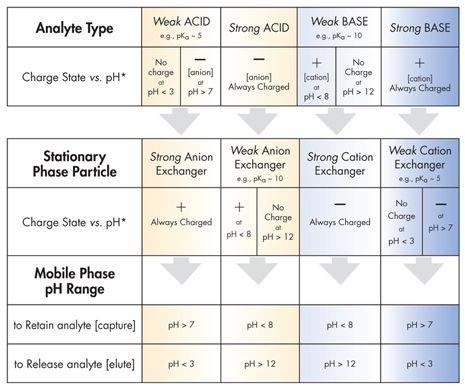
表 D: 离子交换纲要
当弱离子交换体系被中和,它们可以通过疏水性[反相]或亲水性[正相]相互作用保留和分离化合物; 在这样的情况下,洗脱强度由流动相的极性来决定[图 R -1]。因此,弱离子交换体系可用于混合分离模式[同时基于极性和电荷的分离]。表 D 列出离子交换的主要分类纲要。例如,保留强碱性分析物[总是带正电荷],在pH值大于 7 时使用弱阳离子-交换固定相颗粒,可以产生阴离子颗粒表面。为了释放或洗脱强碱物质,降低流动相 pH 值至 3 以下; 可以去除表面电荷,切断离子交换保留机理。pKa 值是 50% 的官能团被离子化,50% 的官能团为中性时的 pH 值。为保证完全中性,或完全带电,分析物或颗粒表面pH值必须调整到比 pKa 值高两个数量级才合适[如表 D 所示]。不要使用强-阳离子交换体系保留强碱物质; 两者都带电荷并强烈地相互吸引,使得碱性物质几乎无法洗脱出来。只能用更强保留的竞争型碱物质来冲洗这个强阳离子交换体系,赢回活性交换位点,替换目标化合物。这种做法在高效液相色谱和固相萃取 SPE 几乎没有实用性,也不安全。[强酸和强碱在操作中很危险,可能对高效液相色谱流路材料具有腐蚀性] 。
基于尺寸大小的分离
排阻色谱[SEC] - 凝胶渗透色谱[GPC]十九世纪五十年代,Porath 和 Flodin发现生物分子可以通过过滤或流经孔径可控的亲水右旋糖苷聚合物时按照大小被分开,而不是基于电荷数或极性。这个过程被称为凝胶过滤。后来,一种类似的装置,使用特定孔径范围的有机聚合物填料可分离合成寡聚物和多聚物。这个过程成为凝胶渗透色谱[GPC]。使用孔径可控的硅胶填料操作类似的分离过程被称作排阻色谱[SEC]。世界上第一台用于 GPC 的商业化高效液相色谱仪出现在 1963 年。
总结
所有这些技术通常是通过固定相来实现。这些固定相为使得感兴趣的分析物进入或不能进入孔内而被合成为一定孔径分布的填料。小分子在通过填料床时更多地进入到颗粒孔隙中。大分子只能进入某一尺寸以上的孔隙,所以在填料床停留的时间较短。最大的分子可能完全不能进入孔内而只在颗粒间通过,因此被小体积流动相很快洗脱出来。选择流动相有两个理由:第一,对被分析物来说是良好的溶剂;第二,可以防止被分析物和固定相表面的相互作用[基于极性或电荷]。这样,大分子先洗脱出来,小分子流动慢[因为它们流进更多的孔内再流出]而后洗脱出来,按照在溶液中的尺寸由高至低的顺序。因此,简单的规则:大的先出来。
由于可以将聚合物的分子量和溶液中的大小相关联,即 GPC 革命性地实现聚合物分子量分布的测量,那样就可以决定聚合物物理特征,从而可提升或减少聚合物生产工艺,质量和性能[如何分辨好的和差的聚合物]。