铯(Cs)
铯是一种银色的碱金属,化学符号Cs。铯在空气中容易氧化。它的同位素中,天然存在的铯-133是一种稳定同位素,而其他铯同位素都有放射性。铯是制造真空件器、光电管等的重要材料,世界上最精确的时钟就用铯制造。铯在化学上用做催化剂。近代以来铯在离子火箭、磁流体发电机和热电换能器等方面也有新的作用。 | 元素名称 | 铯 | 元素符号 | Cs | 原子序数 | 55 | 相对原子质量
(12C=12.0000) | 132.90543 | | 英文名称 | Cesium | | 原子结构 | 原子半径(Å) | 3.34 | 原子体积(cm3/mol) | 71.07 | 电子模型 | 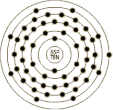
| | 电子构型 | 1s2 2s2p6 3s2p6d10 4s2p6d10 5s2p6 6s1 | 离子半径(Å) | 1.67 | | 共价半径(Å) | 2.35 | 氧化态 | 1 | | 发现 | 1860年由 R. Bunsen 和 G.R. Kirchhoff (德国,海德尔堡)发现。 | | 命名起源 | from 'caesius' (Latin) - sky blue | | 来源 | 存在于铯榴石[(Cs4 Al4Si9O26).H2O]中,极少量存在于锂云母中。 | | 用途 | 作为空气去除剂,用于除去真空管中的痕量空气。由于它很容易电离,被用作离子火箭发动机,也用于光电池,原子钟和红外灯。 | | 物理性质 | 状态 | 软的,轻质银白色碱金属。 | 熔 点(℃) | 28.55 | 沸 点(℃) | 671 | | 密度(g/cc,300K) | 1.873 | 比 热(J/gK) | 0.24 | 蒸发热(KJ/mol) | 67.74 | | 熔化热(KJ/mol) | 2.092 | 导电率(106/cm) | 0.0489 | 导热系数(W/cmK) | 0.359 | | 自燃点(℃) | - | 闪 点(℃) | - | | | | 化学性质 | | | 地质数据 | 丰 度 | | 滞留时间(年) | 600000 | 太阳
(相对于 H=1×1012) | <80 | | 海水中(ppm) | 3.0×10-4 | 地壳(ppm) | 3 | 大西洋表面 | - | | 太平洋表面 | - | 大气(ppm(体积)) | - | 大西洋深处 | - | | 太平洋深处 | - | | | | | | 生物数据 | 人体中含量 | | 肝(ppm) | 0.04-0.05 | | 器官中 | | 肌肉(ppm) | 0.07-1.6 | | 血(mg dm-3) | 0.0038 | 日摄入量(mg) | 0.004-0.03 | | 骨(ppm) | 0.013-0.052 | 人(70Kg)均体内总量(mg) | c.6 |
铯的同位素信息 | 同位素 | % | 质量 | 自旋 | 核磁矩 | 磁旋比 | Q | 频率 | 吸收率 | | 133 | 100 | 132.905447 | 7/2 | 2.9277407 | 3.5332539 | -0.343 | 13.116142 | 4.84×10-2 | | [134] | 0 | 133.906713 | | | | | | | | [135] | 0 | 134.905972 | | | | | | | | [137] | 0 | 136.907084 | | | | | | |
| |
您可能感兴趣的产品:
|