Cytena单细胞打印机助力定点整合细胞株开发
作者:艾贝泰 2024.06.11 点击168次
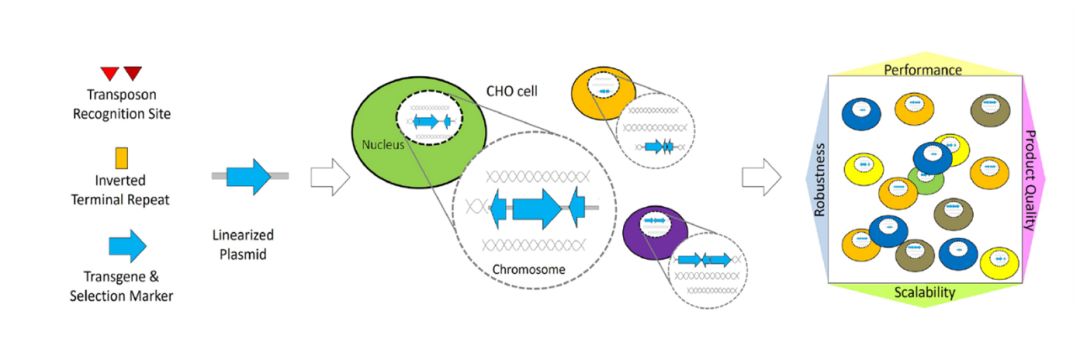
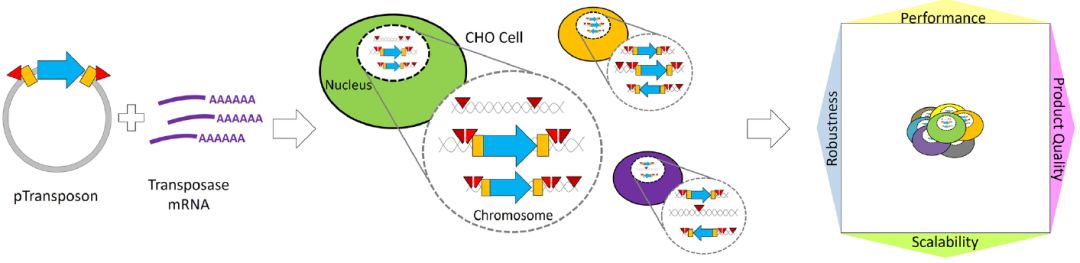
近年来,为更快地将创新疗法带给患者,加快药物开发进程已成为生物制药行业的主要关注点。重组中国仓鼠卵巢 (CHO) 细胞系是单克隆抗体 (mAb) 的主要表达系统,为了加快生物制药进程,如何提高宿主细胞外源基因表达量及稳定性水平是个棘手的热门话题,目前通常通过将遗传信息随机转基因整合 (RTI:Random Transgene Integration)到宿主细胞基因组中产生,即通过选择性标记进行多轮筛选以获得具有高表达水平的克隆。而由于缺乏对随机整合插入位点的控制,部分克隆细胞系的重组蛋白生产力可能会随着时间的推移而减少,导致细胞系不稳定。因此,RTI代表了一种容易出错且乏味的方法,导致开发时间很长。定点整合 (SSI:Site-Specific Integration) 被确定为 RTI的一种有前途的替代品,因为它可以更快速地生成高性能和稳定的生产细胞系,加速药物开发进程。 RTI技术与SSI技术区别
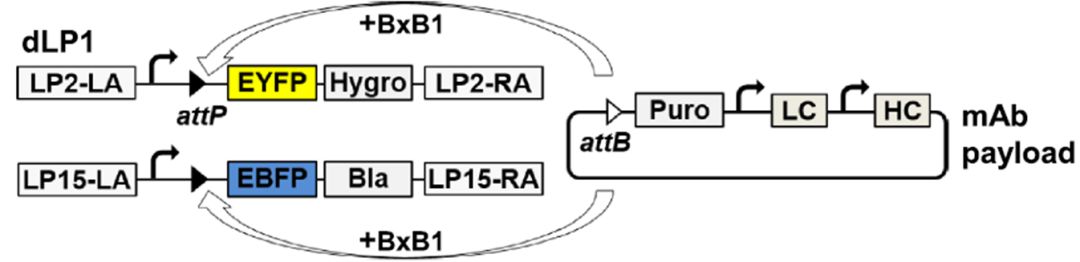
基于RTI(上图)与SSI(下图)的细胞系开发过程图示[1] 在基于RTI的细胞系开发过程中,携带转基因遗传信息和选择标记的线性化质粒稳定地整合到CHO宿主细胞的基因组中。因此,具有不可预测结构的多拷贝转基因整合将发生在未知基因组位点上,代谢选择后产生的细胞库显示出高水平的基因组和表型多样性。对于基于SSI的CLD,能够在基因组的特定位点精确插入或整合外源DNA片段,从而实现对特定基因的添加、删除或替换,可使得细胞库显示出较低的表型异质性。相比于RTI,SSI具有高整合效率、外源基因可实现精确定位、基因表达具有一致性、减少位置效应使得基因表达受控、提高细胞株的安全性及简化筛选流程等优势。 常见的SSI技术方法 1、 CRISPR-Cas系统: 利用CRISPR-Cas9或其他变体,结合特异性向导RNA(sgRNA),在基因组中特定位置切割DNA,并通过同源重组修复(HDR)或非同源末端连接(NHEJ)插入外源DNA。 2、 转座酶系统: 如Sleeping Beauty、piggyBac转座子系统,通过转座酶在特定位置插入外源基因。 3、 重组(整合)酶系统: 如BxB1、Cre-LoxP、FLP-FRT和PhiC31等系统,通过特异性识别序列进行重组,实现外源DNA的整合。 重组酶系统01 BxB1整合酶定点整合外源基因 Gaidukov L, Wroblewska L等人[2]2018年发表于Nucleic Acids Research的文章,确定了21个支持转基因稳定长期表达的新基因组位点,然后在选定的位点构建了包含一个、两个或三个“着陆垫”重组位点的细胞系。通过在每个位点使用高效的BxB1重组酶以及不同的选择标记,将重组酶介导的异源DNA插入到选定的位点,包括通过单次转染靶向所有三个位点。使用这种方法可控地整合多达9个拷贝的单克隆抗体,代表21个转录单元中约100 kb的异源DNA。由于整合针对预先验证的位点,重组蛋白表达在数周内保持稳定,并且整合有效载荷中抗体盒的额外拷贝导致抗体表达线性增加。总体而言,该多拷贝位点特异性整合平台允许将大量DNA可控且可重复地插入稳定的基因组位点,在哺乳动物合成生物学、重组蛋白生产和生物制造方面具有广泛的应用。
BxB1整合酶定点整合外源基因
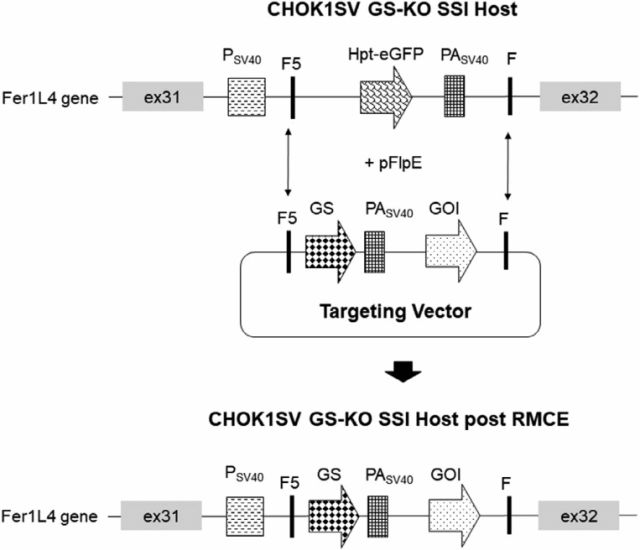
02 FLP/FRT重组酶定点整合外源基因 Feary M, Moffat MA等人[3]在2021年发表于Biotechnology Progress的文章, 将Fer1L4位点与CHOK1SV谷氨酰胺合成酶敲除 (GS-KO) 宿主相结合,创建了一个改进的CHOK1SV GS-KO 定点整合表达系统。CHOK1SV GS-KO SSI宿主是通过同源定向整合Fer1L4基因中不相容的Frt序列的靶向着陆垫创建的,靶向载体包含无启动子GS表达盒和mAb表达盒,两侧是与宿主细胞系中着陆垫两侧的等效位点兼容的Frt 位点。
FLP/FRT重组酶定点整合外源基因图示
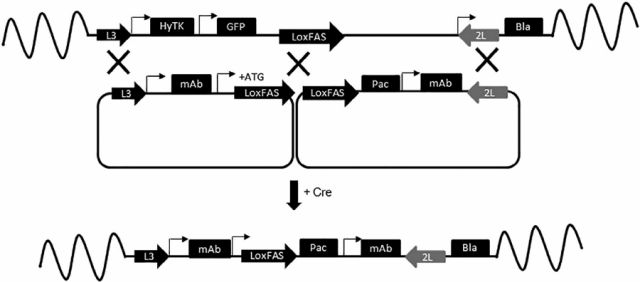
03 Cre/Lox重组酶定点整合外源基因 Zhou M, Crawford Y等人[4]在2021年发表于Biotechnology Progress的文章,利用Cre/Lox重组酶介导的盒式交换(RMCE)将表达抗体的盒引入预定位点,建立了CHO-K1-M衍生的SSI宿主细胞。两个SSI宿主细胞都包含一个表达GFP的着陆垫,两侧是两个不兼容的LoxP重组位点(L3和2L)。此外,在GFP着陆垫中插入了第三个不相容的LoxP位点(LoxFAS),以实现基于双质粒的创新RMCE策略,其中两个独立的载体可以同时靶向单个位点。
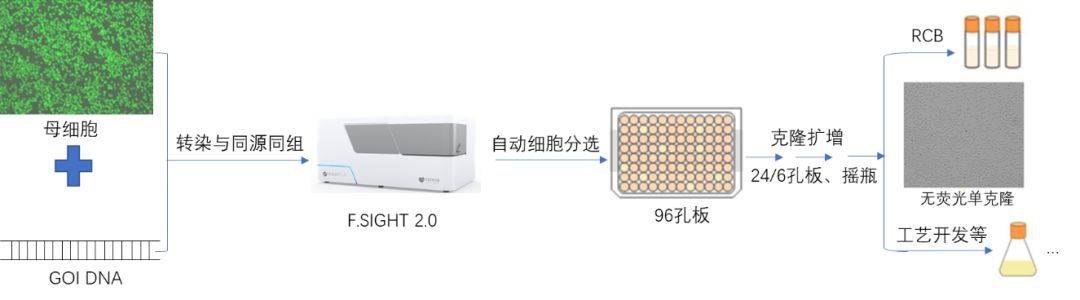
Cre/Lox重组酶定点整合外源基因图示 目前,已有一些知名制药企业(武田制药、罗氏、强生等)利用智能定点整合技术优化其生物药物的生产流程,包括开发稳定细胞株用于大规模生产。而利用整合酶定点整合外源基因的方式对于国内制药企业来说目前还是处于萌芽阶段。但定点整合技术对抗体药物开发带来的前景是可预期的,众多生物制药企业一直期盼能尽快将定点整合应用于自身平台中,加速细胞株的开发。 案例分享(以重组酶系统为例) 通过定点整合技术,将目标基因序列通过同源重组的方式转染到已经通过前期筛选验证过的活跃位点当中,构建均一细胞池。其首先需要构建平台细胞,利用报告基因(如GFP 等) 筛选得到宿主细胞基因组中的高表达位点,之后利用重组酶的特异性,实现将目标产品基因插入在该表达量高、质量和表达量稳定的宿主细胞基因组位点,再利用Cytena克隆筛选单细胞打印系统,获得稳定及高产的单克隆细胞株。
定点整合单克隆筛选流程
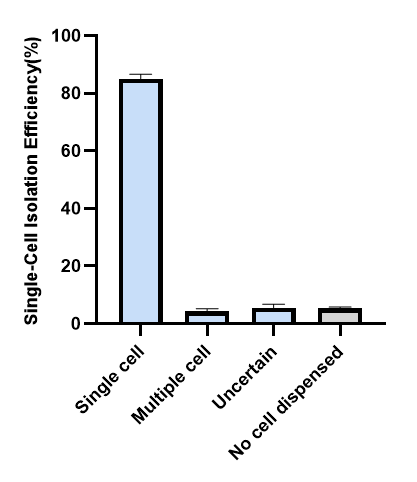
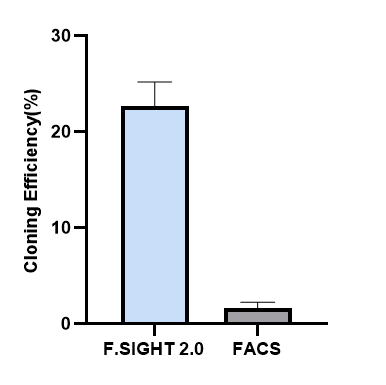
细胞类型:CHO-K1 细胞状态:35%阳性率;80%活率 单细胞挑选设备:Cytena克隆筛选单细胞打印系统,对照组:FACS 单细胞、单克隆率:
通过无荧光转化子同源同组,细胞样品内有带有荧光的母细胞也有无荧光即转化子同组成功的目的细胞,12天后采用Cytena克隆筛选单细胞打印系统进行无荧光细胞铺板(只分选非荧光的细胞),单细率约为85%,克隆恢复率约为20%,而对照组流式由于分选过程对单细胞状态及活力造成损伤,后续单细胞难以恢复成克隆。此流程可以省去minipool与有限稀释的环节,加快开发流程,值得一提的是,用定点整合方式,经单细胞打印系统分选获得的单克隆,后续产量>5g/L,约为随机整合表达量的1.5-2倍,此流程可降低开发时间和成本,提升开发效能,大大缩短整个工艺开发及IND申报时间。
智能定点整合技术在单克隆细胞株筛选中具有高效、精确和安全等显著优势,当然其也面临技术复杂、成本高以及潜在脱靶效应等挑战,选择使用SSI技术需综合考虑实验目的、成本和技术能力等因素。
参考资料 [1] Schmieder V , Fieder J , Drerup R ,et al.Towards maximum acceleration of monoclonal antibody development: Leveraging transposase-mediated cell line generation to enable GMP manufacturing within 3 months using a stable pool[J].Journal of Biotechnology, 2022(349-):349.DOI:10.1016/j.jbiotec.2022.03.010. [2] A multi-landing pad DNA integration platform for mammalian cell engineering. Nucleic Acids Res.Gaidukov L, Wroblewska L, Teague B, Nelson T, Zhang X, Liu Y, Jagtap K etc.(2018) [3]CHOK1SV GS-KO SSI expression system: A combination of the Fer1L4 locus and glutamine synthetase selection. Biotechnol Prog.Feary M, Moffat MA, Casperson GF, Allen MJ, Young RJ.(2021) [4]Development of a targeted integration Chinese hamster ovary host directly targeting either one or two vectors simultaneously to a single locus using the Cre/Lox recombinase-mediated cassette exchange system. Biotechnol Prog. Ng D, Zhou M, Zhan D, Yip S, Ko P, Yim M, etc.(2021) | 产品分类
最新产品
重点推荐产品
|
 |