Cytena单细胞打印机助力新冠病毒棘突蛋白的开发
2022.07.21 点击7664次
自新型冠状病毒肺炎(COVID-19)爆发以来,截至目前为止全球感染新型冠状病毒的病例一亿八千多万,死亡病例三百九十多万,我国感染病例亦有十一万多,现每日仍有病例不断报出,感染病例也不断上升。此次大流行由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)所引起的一种新发型急性呼吸道传染病,疫情几乎蔓延至所有的国家,给全球社会经济带来了极大灾难,也成为了目前全球最大的公共卫生事件。 因此,认识和理解COVID-19感染途径和发病机制对其防控和治疗具有重要意义。作为新平台,单细胞技术的成熟在整个生命科学领域的广泛应用催生了许多重要的生物学发现,也意味着在临床研究上会有一批新的突破,所以单细胞分离筛选在SARS-CoV-2研究中起到尤为重要的作用。
自20世纪30年代末以来,人们就知道了动物冠状病毒,最近的研究将Human coronaviruses (HCoVs)的进化与加速的城市化和家禽养殖联系起来;这些做法允许频繁的物种交换和简化物种屏障的跨越,研究人员通过研究SARS-CoV-2和相关sarbecovirus (SARS-CoV-2属于蝙蝠和穿山甲病毒的病毒群)的突变过程发现了相当显著的变化,早在1983年,有证据强烈表明单峰骆驼是MERS CoV的重要宿主;据预测,这种祖传病毒会从蝙蝠身上跨越物种屏障,进入单峰骆驼体内。后来,穿山甲被认为是SARS-CoV-2的潜在中间宿主,因为它与穿山甲中的CoV具有99%的遗传同源性;但它们都是在SARS-CoV-2出现在人类之前。这也说明,许多冠状病毒具有“通才”的特性且在宿主之间跳跃能力明显,而这一特性使得冠状病毒可能在传染给人类之前就已经在蝙蝠中得到进化了[1]。
图1. 冠状病毒的起源和向人类的传播途径 大流行的人类冠状病毒的棘突蛋白对于其进入人体细胞至关重要。事实上,大多数针对严重急性呼吸系统综合冠状病毒 2 (SARS-CoV-2) 的中和抗体是针对病毒表面暴露的棘突蛋白,使其成为疫苗和诊断测试的首选抗原。在当前大流行的背景下,全球对棘突蛋白的需求迅速增加,每年可能超过数百克至公斤。冠状病毒棘突是高度糖基化的同源三聚体复合物,具有固有的结构灵活性和不稳定性。可制造性差现威胁到这些蛋白质用于疫苗和诊断测试的可用性。所以寻求一种能够稳定生产三聚体棘突蛋白(Trimeric spike protein,S蛋白)的工艺尤为重要。
SARS-CoV-2 S蛋白的设计 SARS-CoV-2 S蛋白的编码DNA的密码子经过优化,一共设计了11个DNA结构体(图2),并由ATUM公司合成。添加了一个功能性IgG先导序列来介导有效的信号肽切割。添加编码组氨酸(8-聚体)的DNA用于羧基末端表达。如前所述,furin裂解位点RRAR突变为非功能性。在三聚体设计中,将跨膜区和C端细胞内的尾端去除,用一个T4折叠子序列取代。对于RBD片段(aa319-541),添加了IgG leader和His标签序列。由于携带D614G氨基酸变化的SARS-CoV-2变异体的广泛出现,本研究中也包括了这种棘突蛋白变异 。
图 2. Schematic representation of SARS-CoV-2 spike protein designs.
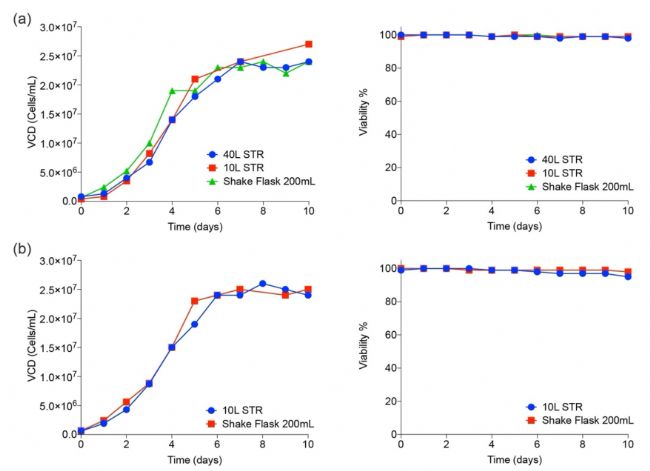
单克隆细胞株的筛选和三聚体棘突蛋白表达 采用CHO4Tx的转染试剂,在无动物来源的培养基中,将包含SARS-CoV-2 棘突蛋白的DNA序列的pXLG-6载体转染CHOExpressTM细胞。该载体包括用于嘌呤霉素抗性标记物的表达盒。转染后的细胞用嘌呤霉素进行筛选,对于wuhan突变毒株,采用德国 cytena 的 f.sight 单细胞打印机筛选单克隆细胞株。将高水平表达的三聚体S蛋白和RDB单体的细胞株扩增并冻存。RBD棘突片段的重组细胞系和三聚体S蛋白的克隆细胞系在优化的补料分批工艺中,以0.2-,10-和50-L的生物反应器中放大培养。 从300个单克隆衍生的细胞群中,挑选出三聚体棘突(trimeric spike)和受体结合域(RBD)表达水平最高的细胞群进行扩增,并开发了补料分批生产工艺。生产过程逐步扩大到200mL摇瓶、10L和40L搅拌槽生物反应体系。活细胞密度(VCD)和存活率可保持高达10天(图3)。观察到三聚体棘突蛋白和RDB单体在各种培养规格下最终收获滴度均为数百毫克/升。
Figure3. Cell culture scale-up performance in shake flasks and bioreactors. 三聚体棘突(a)和RBD(b)的活细胞密度(细胞/mL)和活细胞(%)。
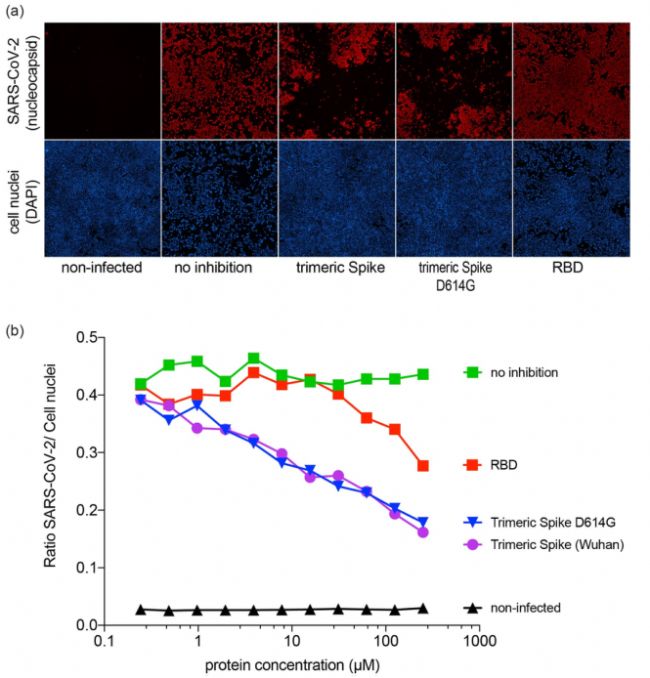
SARS-CoV-2的棘突蛋白对SARS-CoV-2感染的抑制作用 将SARS-CoV-2病毒与连续稀释的RBD或三聚体棘突混合,并将混合物接种到Vero E6细胞上。48h后发现RBD棘突片段和三聚体棘突的存在减少了Vero E6细胞的感染。表明CHO产生的三聚体棘突和RBD能够与SARS-CoV-2竞争与宿主细胞的结合。在614D(武汉)和D614G三聚体棘突变体之间未观察到差异[2]。
图4. CHO产生的三聚体棘突和 RBD可抑制SARS-CoV-2感染 (a)三聚体棘突和RBD对Vero E6细胞感染的抑制作用, 病毒核衣壳抗原染色(红色),细胞核染色(蓝色);并对其进行统计分析(b)。
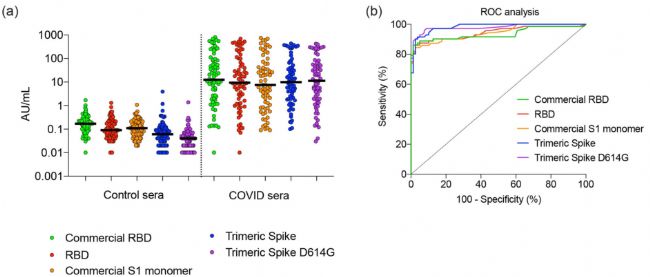
SARS-CoV-2棘突蛋白检测抗体的敏感性和特异性 我们特别选择了一组2019冠状病毒疾病血清样本,这些样本涵盖了大量SARS-CoV-2特异性抗体浓度。通过对三聚体棘突蛋白和RBD蛋白用于血清学分析中检测SARS-CoV-2特异性IgG。发现新冠病毒样本的中值信号强度比对照样本高400倍以上(图5a)。统计分析显示,S1单体和两种RBD的ROC之间没有差异,武汉和D614G三聚体棘突之间也没有差异。此外,我们的结果表明,CHO产生的三聚体棘突比S1单体和RBD具有更高的诊断特异性和敏感性。
图 5. CHO产生的三聚体棘突具有更高的诊断特异性和敏感性 (a)在症状出现的第4-40天收集的对照血清(n=151)和 2019冠状病毒疾病血清(n=72)进行了测试, 并比较了免疫球蛋白G的浓度。(b)用 ROC分析(a)中检测的血清。 Cytena单细胞打印机温和筛选的原理保证了CHO具有较高的活性,为下游的扩展生产工艺奠定了基础,以提供足够数量的具有哺乳动物型糖基化的三聚体SARS-CoV-2棘突蛋白。功能分析表明,三聚体SARS-CoV-2棘突蛋白能够有效地阻断病毒的传染性。此外,三聚体棘突对SARS-CoV-2特异性IgG的诊断性能超过RDB和单体S1蛋白。 参考文献: [1].Kirtipal N , Bharadwaj S , Kang S G . From SARS to SARS-CoV-2, insights on structure, pathogenicity and immunity aspects of pandemic human coronaviruses[J]. Infection Genetics and Evolution, 2020, 85:104502.[1] Kirtipal N , Bharadwaj S , Kang S G . From SARS to SARS-CoV-2, insights on structure, pathogenicity and immunity aspects of pandemic human coronaviruses[J]. Infection Genetics and Evolution, 2020, 85:104502. [2]. Pino P , Kint J , Kiseljak D , et al. Trimeric SARS-CoV-2 Spike Proteins Produced from CHO Cells in Bioreactors Are High-Quality Antigens[J]. Processes, 2020, 8(12).Pino P , Kint J , Kiseljak D , et al. Trimeric SARS-CoV-2 Spike Proteins Produced from CHO Cells in Bioreactors Are High-Quality Antigens[J]. Processes, 2020, 8(12). | 产品分类
最新产品
重点推荐产品
|
 |