《mRNA-LNP疫苗的结构与稳定性》文献解读总集篇
作者:AVT 2021.09.13 点击2109次
摘要: 当前mRNA脂质纳米粒(LNP)疫苗的一个缺点是它们必须在(超)di温下储存,了解这些疫苗不稳性的根本有助于我们合理提高mRNA-LNP产品的稳定性,从而降低对储存温度的要求。在这篇综述中,我们讨论了mRNA-LNP可能的内部结构、影响mRNA-LNP稳定性的因素以及优化mRNA-LNP产品稳定性的策略。对mRNA-LNP结构的分析表明,mRNA、可电离的阳离子脂质和水存在于LNP中,中性辅助脂质主要位于包裹的外壁。mRNA水解是mRNA-LNP不稳定的主要因素。目前尚不清楚LNP中的水如何与mRNA相互作用,以及mRNA的易降解位点通过与可离子化的阳离子脂质的结合而受到多大程度地保护。为了提高mRNA-LNP疫苗的稳定性,首先,应优化mRNA的核苷酸组成。其次,更好地了解mRNA在LNP中所处的环境可能有助于合理调整LNP结构以保持mRNA的完整性。此外,干燥技术如冻干,可能是仍有待探索的可行途径。
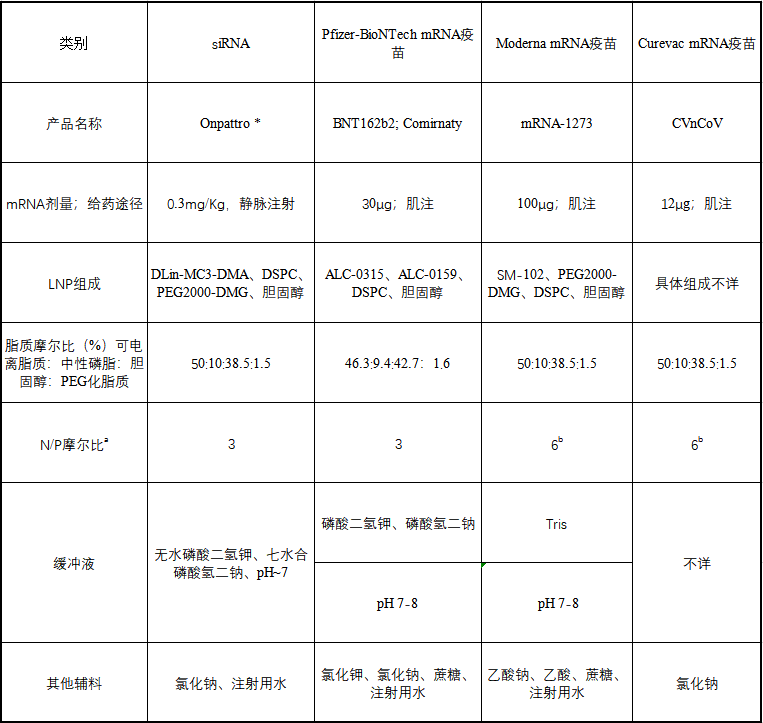
1、背景介绍 当下正在开发的许多疫苗中,有两款疫苗已在预防感中显示出高效保护率,这两款疫苗代着新一代疫苗产品:它们由脂质纳米粒包裹信使核糖核酸链(mRNA)。BioNTech/Pfizer和Moderna开发的这些mRNA疫苗的保护效力约为95%,并且是首批获得FDA“紧急使用授权”和EMA “条件批准”的mRNA疫苗。疫苗mRNA编码SARS-CoV-2病毒的刺突(S)糖蛋白,其中包括两个脯氨酸替换(K986P和V987P突变),以稳定糖蛋白的融合前构象。在肌肉 (IM) 注射给药后,LNP系统使宿主细胞能够摄取并递送mRNA 到细胞质内,其中mRNA序列在核糖体中翻译成S蛋白。在宿主细胞进行翻译后加工后,S蛋白在细胞表面以其融合前构象作为膜结合抗原被呈递,为B细胞提供抗原靶标。此外,部分翻译表达的S蛋白进入抗原呈递途径,通过T细胞表位的组织相容性复合体(MHC)呈递提供T细胞的抗原识别。EMA评估报告将mRNA疫苗在注射部位的作用机制认定如下:“注射LNP包裹的mRNA疫苗会导致短暂的局部炎症,从而促使中性粒细胞和抗原呈递细胞(APC)募集到注射部位,招募的APC能够摄取 LNP纳米粒继而表达S蛋白,随后可以迁移到发生T细胞的局部淋巴结”,由于这种固有的先天免疫,没有必要用额外的佐剂配制mRNA疫苗。有趣的是,辉瑞/BioNTech和Moderna专门使用修饰后的核糖核苷酸来构建mRNA,以降低(而不是提高)mRNA固有的免疫原性,强调需要适当平衡mRNA疫苗的先天免疫活性(下文详细讨论)。体内抗原表达可以通过疫苗给药后来实现,与mRNA疫苗的自佐剂特性相配合,终产生有效地中和抗体应答和细胞免疫,从而为疫苗接受者降低感的风险。 与其他类型的疫苗相比,mRNA疫苗有几个优点。mRNA疫苗的一个普遍优势是它们的开发相对较快,因为mRNA-LNP是一种平台技术。在鉴定保护性蛋白抗原并对相应基因进行测序后,可在数周内制备mRNA。由于编码不同抗原的mRNA在化学和物理上高度相似,新mRNA疫苗的配方设计和制造过程遵循相同的步骤。与有复制缺陷的病毒型载体相比,mRNA疫苗可能有更高的病毒保护效力。与基于病毒载体的疫苗不同,机体不会对载体产生免疫反应。在这方面,mRNA疫苗类似于基于脱氧核糖核酸(DNA)的疫苗。然而,DNA疫苗仍有极小的机会进行潜在的基因组整合。此外,与mRNA疫苗相比,DNA疫苗在早期临床试验中显示出相当低的免疫原性,这可能是因为基于DNA的疫苗需要进入细胞核才能发挥作用,从而使有效递送变得复杂。总体而言,灵活的设计、标准化的生产流程和相对较短的细胞质存在时间使mRNA疫苗非常有优势,尤其是在病毒快速变异的大流行背景下。 然而,在开发 mRNA疫苗时遇到的挑战之一是它们的稳定性差。目前,大多数mRNA疫苗是通过肌肉注射给药的,在注射部位被宿主细胞摄取mRNA继而表达出抗原。mRNA疫苗的早期研究表明,裸露的mRNA在给药后会迅速降解。因此,在过去很多年,人们一直在努力改善体内给药后mRNA的稳定性,一种方法是通过优化mRNA结构的方法来减缓其降解。另一种成功且目前广使用的方法是用LNP将mRNA包封,从而保护 LNP中的mRNA。这减少了给药后mRNA过早的降解,并增强了向抗原呈递细胞胞内递送的能力。 尽管目前在提高mRNA-LNP疫苗的体内稳定性和功效方面取得了进展,但对其储存过程中的稳定性仍然关注较少。为了疫苗能有效地在全球范围内进行流通,mRNA-LNP疫苗能够在冷藏温度(2-8°C)或更高的温度下有足够长的有效期。目前,公开资料中几乎没有关于mRNA-LNP制剂长期储存稳定性数据。此外,尚不清楚在LNP中包封的mRNA会在多大程度上改善mRNA疫苗的储存稳定性。关于LNP包封mRNA的结构和形态、LNP组分的化学稳定性和mRNA-LNP系统的胶体稳定性也知之甚少。现在已知的是,为了更长时间地储存当前的mRNA疫苗,它们必须被冷冻。目前Moderna和BioNTech/辉瑞的疫苗分别需要在-15~-25℃和-60~-90℃储存,但迄今为止,这两家公司mRNA疫苗产品的降解过程和储存温度要求不同的原因尚不完全清楚。 将mRNA-LNP需要冷冻储存阻碍了疫苗的流通。尤其是,需要储存在-60~-90 °C的极低温,对疫苗在全球运输、储存和流通是个极大的挑战。大多数其他疫苗可以在2–8 °C下储存。显然,当前迫切需要研发出性质更加稳定不需要冷冻储存的mRNA-LNP疫苗。本综述概述了使mRNA疫苗更稳定的方法,以便它们可以在不太极端的温度下储存更长时间。为了探讨该主题,讨论了mRNA-LNP疫苗的特性及其对储存稳定性的影响,以确定mRNA疫苗不稳定的原因并探索提高其稳定性的方法。 mRNA疫苗概述 mRNA-LNP 疫苗的组成是其稳定性的基础。在针对****的疫苗开发过程中,已经有多种不同的 mRNA 候选疫苗。目前,有10种不同的针对**的mRNA疫苗已进入临床试验,包括常规 mRNA疫苗和自扩增 mRNA (SAM)。目前有三种“常规”可编码完整的S蛋白的mRNA 疫苗已获批或处于临床试验后期。它们是 Moderna 的 mRNA-1273 疫苗、BioNTech/Pfizer 的 BNT162b2/Comirnaty 和 CureVac 的 CVnCoV(可见表1)。 有几篇综述对这三种**的 mRNA疫苗进行了详细比较,包括它们在 mRNA 结构和LNP设计方面的差异和相似之处。以下部分旨在概述这些疫苗中mRNA 成分和 LNP递送系统的功能和特征,因为它们对 mRNA 疫苗的体内给药和储存期间的稳定性起着关键作用。 表1 有关目前上市使用或临床 III 期试验的三种 mRNA-LNP疫苗的信息,出于比较原因,添加了 Onpattro(一种 siRNA-LNP 药物产品)的药物产品信息。
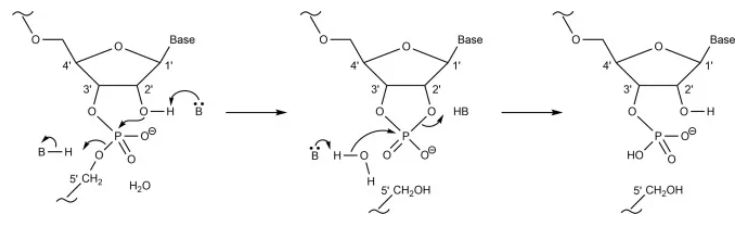
* NDA 210922 ONPATTRO (patisiran) 脂质复合物注射液;药品质量审查附录(FDA,2017 年)。 a N = 可电离的阳离子脂质(氮),P = 核苷酸(磷酸盐)。 b推测 2.1 优化mRNA体内稳定性和翻译能力的mRNA工程 mRNA由于其磷酸基团上带有负电荷,在生理 pH 范围内是以聚阴离子大分子的形式存在。递送mRNA 疫苗的**个障碍是由于核糖核酸酶在细胞外环境中含量丰富,裸露的mRNA在注射后容易被核糖核酸酶 (RNase) 迅速降解。其次, mRNA进入细胞会被细胞内RNA受体识别,包括内体Toll 样受体 (TLR) 和细胞质核酸受体。mRNA与这些宿主防御受体的结合会**先天免疫通路,会导致数百个基因的表达。一方面,这可以为疫苗提供佐剂样作用。另一方面,它导致细胞处于抗病毒状态,这强烈降低了细胞内mRNA的稳定性和翻译表达。摄取进入细胞后, mRNA 链需要与核糖体结合以实现所编码蛋白质的翻译表达。可以通过mRNA工程**改善mRNA 的蛋白质合成速率和功能半衰期,mRNA疫苗中的mRNA链的典型元件示意图如图1所示。 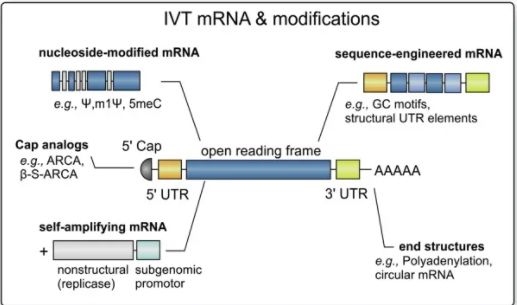 图1 体外转录 (IVT) mRNA 的结构元件。这些序列中的每一个部分都可以优化和修改,以调节mRNA 的稳定性、翻译能力和免疫**能力。 有很多研究尝试提高mRNA 分子的体内稳定性和翻译能力,同时避免不需要的先天免疫**。目前达成共识的是,这可以通过优化 mRNA 的调控区域5' 帽、poly-A 尾和非翻译区 (UTR)来实现。UTR位于mRNA 编码区的两侧,可以调节mRNA的稳定性和翻译。 poly-A尾也能调节mRNA的稳定性,因为它的缩短和去除都会导致 mRNA 的降解。5' 帽结构对于蛋白质生产和翻译启动子的结合很重要。此外,具有**化 GC(鸟嘌呤-胞嘧啶)含量的mRNA 结合密码子优化,即在编码区选择“常用密码子”,可提高稳定性和翻译水平。 另一个关键因素是mRNA的二级结构,它可以通过密码子优化和计算工具来改变一级序列使其稳定。通过选择“高度结构化的编码序列”在mRNA中构建二级结构 (除了5' UTR 区域)也会产生更高的体内翻译水平,因为mRNA体内半衰期得到延长。或者,Mauger等人证明天然存在的修饰尿苷的引入,例如使用1-甲基-假尿苷(m1Ψ)代替尿苷,会带来mRNA二级结构的整体变化,从而达到更高水平的蛋白质表达。 重要的是,目前将RNA结合蛋白对mRNA的胞内识别降至**的***方法是在mRNA中引入这些修饰的尿苷,这些蛋白参与对外来mRNA的先天免疫反应,反过来增强了生物稳定性和翻译能力,同时降低了mRNA 疫苗的免疫原性。此外,还有迹象表明,m1Ψ 提高了mRNA 的碱基堆积和熔点,从而使mRNA更加稳定。 这可能意味着 Moderna 和 BioNTech/Pfizer 的**疫苗,1mΨ的掺入也会提高给药前mRNA 的稳定性。*近有文章发表了对 CureVac在 CVnCoV mRNA 工程中所做工作的有趣分析,CureVac 采用了不同的策略。然而,即使优化了mRNA的结构,直接注射裸露的mRNA 也不会引起强烈的免疫反应,这可能是因为裸露的mRNA的细胞转染能力差和对RNA酶(RNase)敏感。这说明*优化mRNA结构不足以创建有效的 mRNA 疫苗,仍然需要额外的保护和递送系统。 另一种类型的 mRNA 疫苗SAMs不*编码目标抗原,还编码RNA 聚合酶——来自病毒的“自我放大”因子。通常,SAMs由 9 kb 的mRNA核苷酸组成,而非自我复制的mRNA疫苗的序列长度*为2-4 kb。开发 SAM 候选疫苗的目的是替代典型的两剂策略的“启动-加强”方案,而是达到每位接种者单次注射。由于自带的复制能力,SAM疫苗的注射剂量低于传统mRNA疫苗,一剂便可能达到足够保护效力。 当 SAM 在宿主细胞中被翻译时,一种RNA聚合酶合成与编码mRNA 模板互补的反义RNA中间体,再转录为许多编码mRNA 分子,从而使抗原表达延长和增强。目前两种 SAM 疫苗都编码完整的S 蛋白,并且这些疫苗在临床试验中的**剂量比常规mRNA 疫苗的典型剂量低十倍以上。临床开发中的两种SAM 疫苗是伦敦帝国理工学院的nCoVsaRNA 和 Arcturus/Duke-NUS 的 ARCT-021,两种疫苗均采用的是LNP包裹技术。 LNPs 作为递送系统 为了克服裸露的mRNA转染的种种问题,已经开发了保护性递送系统。目前的mRNA疫苗(表 1)都在使用 LNP 技术。这说明了使用LNP能在稳定mRNA 的同时并将其递送到细胞中。mRNA疫苗中的LNP 由四种主要成分组成(见表1):中性磷脂、胆固醇、聚乙二醇 (PEG) 脂质和可电离脂质。可电离脂质含有带正电荷的可电离胺基团(在低 pH 条件下电离),可在颗粒形成过程中与阴离子mRNA 相互作用,并在细胞摄取过程中促进膜融合。此外,PEG化脂质用于控制粒径并充当空间屏障起稳定作用,防止储存过程LNP微粒聚集。通过使用微流控混合生产技术,这些脂质成分与 mRNA 一起形成大小约为 60-100 nm 的颗粒。例如,SARS-CoV-2 候选疫苗nCoVsaRNA和ARCoV的平均粒径分别为75 nm和89 nm。 表一:  LNPs与脂质体的不同之处在于微粒中存在脂质,来自几项研究的数据表明水也存在于微粒内部某些空间。这意味着mRNA即使被包封也可能暴露于水性环境中。这种类型的内部结构,先前已在未包载和包载siRNA的LNP中被冷冻电镜所观察到。类似地,mRNA-LNPs 的冷冻电镜结果也显示了电子致密核,劳氏紫(Thionine)对RNA进行染色用于冷冻电镜对比度增强(见图2)。 尽管mRNA-LNP 的共同特征是脂质,但该的确切结构特征及其对脂质成分(摩尔比)和 mRNA 定位的依赖性仍存在争议(见图3)。正如 RiboGreen检测实验所确定的那样,mRNA 肯定位于 LNP 内部。RiboGreen 是一种染料,当与单链 mRNA 结合时会显示荧光,但不能进入 LNP。在 mRNA-LNP 制剂中,例如mRNA 疫苗的制剂,可与RiboGreen结合产生荧光的mRNA 比例非常低,因此,采用RiboGreen来测定的包封率通常 > 90%。综上所述,冷冻电镜(图2) 和包封率证据表明,mRNA-LNPs形成纳米粒子,其中包封了 mRNA,可免受外部介质的影响,LNPs包封的mRNA的结构有3种模型,这些主要来源于siRNA-LNPs分析(图3)。  图2 mRNA-LNP 的冷冻电镜图像显示具有明显不同电子密度的“囊泡”结构  图3 siRNA-LNP 和 mRNA-LNP 结构的推测模型的示意图 A:多层囊泡;B:纳米结构核;C:均质核壳 mRNA疫苗所包封的mRNA会影响终LNP的结构:siRNA 在结构和分子量大小上与 mRNA 有很大不同(表 2)并且N/P(可电离的阳离子脂质与核苷酸磷酸盐)摩尔比不同,N/P摩尔比分别为3和6(表 1)。mRNA 至少比 siRNA 大 100 倍,这会影响 LNP 的结构。此外,有迹象表明 mRNA 位于 LNP 的核,而siRNA 更靠近表面,mRNA 可以形成“囊泡”(图 2)。LNP 囊泡部分的组成是一个有争议的问题,在这种状态时:“mRNA 可以从带电的脂质中解离,留在充满溶剂的囊泡隔室中”。 表2 mRNA 和siRNA分子之间的差异 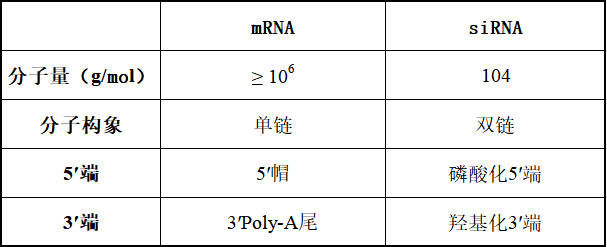 mRNA-LNP不太可能是(图 3A)的多层囊泡模型。它与mRNA-LNP的 TEM结果中电子致密核位置不对应。目前,大多数研究人员认为 mRNA-LNP 贴近核壳模型(图3 B和C),这意味着纳米颗粒具有表面层和无定形的各向同性核。Viger-Gravel等,使用核磁共振光谱证明LNP结构的两种类型的核是可能的。 他们描述了一个被阳离子脂质包围(图3B)的包含水孔的无定形核模型。他们还假设核中的脂质可以均匀分散,中间有“小水球”(图 3C)。后者(图3B和C)跟siRNA-LNPs和mRNA-LNPs在实验观察到的结果更吻合。 Arteta等人,使用冷冻电镜、小角 X 射线散射 (SAXS) 和小角度中子散射 (SANS) 测量 mRNA-LNP 结构模型。他们发现DSPC和PEG化脂质以及部分可电离的阳离子脂质和胆固醇是位于LNP 的表面,可电离的阳离子脂质、胆固醇(取决于其浓度)、水和 mRNA 的主要部分分布在核内部。有趣的是,他们的研究表明,各向同性LNP 核由24%(体积分数)的水组成。他们指出 mRNA 位于水柱内,水柱被阳离子脂质包围(如图4所示)。这意味着 mRNA 至少部分暴露于LNP 内部的水中,这可能导致mRNA在非冷冻条件下储存时不稳定,Sebastiani等人也报道了类似的结果。 因此,研究 mRNA 如何与 LNP 中的水和可电离的阳离子脂质相互作用是一件很有趣的事。mRNA 是亲水的,它可以通过静电和氢键与可电离的阳离子脂质相互作用(通常表观pKa < 6.5)。这取决于 LNP 内部的pH值,如果 LNP 外壳对质子具有渗透性——这很可能,因为 2-(对甲苯胺基)-6-萘磺酸 (TNS) 和劳氏紫等离子化染料可以进入 LNP 核,那么LNP内部的pH值与制剂的其余部分应该相似,约为7 到 8,这意味着大多数可电离的阳离子脂质将不带电。 然而,由于可电离的阳离子脂质堆积在核中,它们可能表现出聚电解质行为,导致 Henderson-Hasselbalch 方程的偏差,即滴定曲线的“拖尾”(脂质膜内的可电离脂质的表观pKa可能与实际值有较大偏差,这意味着pKa为6.5左右的可电离脂质在脂质膜内的表观pKa可能与理论值有1~2个pKa单位的偏差,所以pKa为6.5左右的可电离脂质在pH值为7-8之间的脂膜内时,依然有可能绝大部分呈现带正电的状态,注:红色斜体部分是对一些较复杂概念的进一步解读,后同)。此外,mRNA 和可电离的阳离子脂质之间的相互作用可能会影响电离行为。 对于 siRNA,发现与可电离阳离子脂质存在较弱的静电相互作用,这表明至少对于 siRNA-LNP 制剂,内部的pH值接近或等于外部的pH值。对于 mRNA-LNP,尚未进行此类实验研究。mRNA 和阳离子脂质复合的分子动力学模拟研究证明了脂质-脂质簇和脂质-mRNA 簇的形成。静电力和氢键都在驱动阳离子脂质和 mRNA 的相互作用。  图4 mRNA-LNPs核中mRNA-水柱的示意图 Arteta 等人的另一个有趣发现是他们的mRNA-LNP 的外壳是单层的。其他研究人员根据冷冻电镜(图 2)或 SANS结果分析提出,mRNA-LNPs 的外壳由一个或多个双层组成。这些相互矛盾的发现表明,使用这些技术评估mRNA-LNP 壳的性质是困难的,可能存在多种类型的mRNA-LNP 结构,其结构取决于脂质的性质和mRNA-LNP 的制备方法。反过来,不同的结构可能会对不同配方的稳定性产生影响。总之,问题仍然在于目前我们尚不清楚 mRNA-LNP 的结构以及包封的mRNA 与各种脂质成分之间的相互作用。 对各种 mRNA疫苗成分的分析表明,它们具有共同特征,但也存在差异(表 1)。LNP 配方、修饰核苷的使用、高GC含量以及常规 mRNA 和 SAM 疫苗之间的长度差异可能会影响这些 mRNA疫苗在储存过程中的物理和化学稳定性。 mRNA疫苗的体外稳定性 正如之前在背景介绍中提到的,目前已批准的 mRNA疫苗流通的主要障碍之一是它们必须以冷冻形式储存。在 2–8 °C 的温度下,辉瑞/BioNTech 和 Moderna 疫苗分别可稳定保存 5 天和 30 天,两家公司都为终端使用提供了详细的处理说明。有趣的是,据报道 CureVac 的候选疫苗在冰箱温度和 -60 °C 下可稳定 3 个月。这些是目前发布了mRNA-LNP长期储存条件的制造商,这种苛刻的温度要求严重影响了这些疫苗的储存、运输和流通。然而,迄今为止,在公开资料中几乎没有关于优化mRNA 疫苗稳定性的信息。本节旨在概述影响 mRNA-LNP 疫苗成分稳定性的因素,并讨论分析评价这种稳定性的方法。 mRNA稳定性 强烈影响所需储存条件的主要因素是 mRNA 的稳定性。如上文2.1 节所述,mRNA 分子的结构经过专门设计可以用于增加体内靶抗原的翻译。mRNA 的特殊性在于,即使是长 mRNA 链(通常长度在 1000 到 5000 个核苷酸之间)中的一个核苷酸发生变化(链断裂或碱基氧化)便会导致翻译终止。这使得 mRNA 疫苗与其他疫苗完全不同,在其他疫苗中,抗原的微小变化不一定对其功效产生显影响。因此,对于 mRNA 疫苗,监测整个分子的完整性是至关重要的。 mRNA 降解的方式有多种,可以分为化学和物理降解。化学降解包括 mRNA 分子中化学键的改变。物理不稳定性包括变性(二级和三级结构的丧失),与变性对蛋白质生物制剂活性的影响不同,物理不稳定性对mRNA的影响可能不太明显。然而,变性还包括聚集和沉淀等变化,这些变化会影响mRNA的翻译表达。在一篇关于核酸稳定性的综述中,Pogocki 和 Schöneich 指出化学降解在siRNA降解中的影响比物理不稳定性更大,对于链长更长的 mRNA来说可能更是如此。 mRNA在体外的化学降解主要包括水解和氧化,水解主要是发生在mRNA 分子骨架的磷酸二酯键(图5 )。核糖上的2' OH 基团起着至关重要的作用,因为导致 mRNA 链断裂的酯交换反应起始于磷酸酯键上的 2'OH 基团的亲核进攻导致 P-O5' 酯键断裂(图5)。这个过程需要水,可以被核酸酶催化,也可以被 mRNA 分子本身和其他外源因素如酸和碱催化。在有关 mRNA 水解的两篇文献中,作者指出 mRNA 的碱基序列和二级结构会影响水解速率。具体而言,碱基堆积可能会降低磷酸二酯键的裂解速率,可以小化 mRNA 分子的“平均未配对概率”。可以使用专门设计的算法来选择可以形成大双链区域的单链 mRNA 的核苷酸序列。据称,采用这种方法优化后,体外稳定性得到了改善。 CureVac、辉瑞/BioNTech 和 Moderna 疫苗之间的区别在于后两者具有 1-甲基-假尿苷的单核苷掺入。之前的一项研究表明,这种修饰提高了 RNA 二级结构的稳定性。CureVac 采用提高GC比例策略,具有类似的效果。
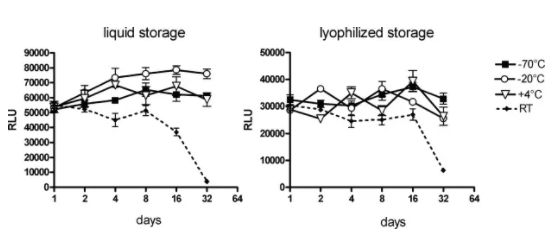
图5 通过 2',3'-环状磷酸酯,碱基催化RNA分子内的磷酸二酯键水解、B表示Brønsted碱。 相反,氧化会影响碱基,并在较小程度上影响mRNA 核糖单位的糖基团。氧化可导致碱基裂解、链断裂和 mRNA 二级结构的改变。然而,如前所述,水解似乎被认为是驱动 mRNA 降解的关键因素。 LNP稳定性 除了mRNA 的完整性外,LNP 的稳定性对于 mRNA-LNP 疫苗的质量也至关重要。目前的mRNA疫苗没有披露关于LNP 稳定性测试的数据,但 Onpattro (patisaran) 的siRNA-LNP 制剂保存在2~8°C 之间时具有三年的有效期,同时该产品不能冷冻保存。 Onpattro 的LNP 系统的组成是:可电离的阳离子脂质DLin-MC3-DMA、DSPC、胆固醇、PEG2000-C-DMG(见表 1)(摩尔比 50:10:38.5:1.5),它们在组成上类似于 Comirnaty 和 mRNA-1273的LNP。在一项siRNA-LNPs 的研究中用类脂质306O 13代替DLin-MC3-DMA,样品水溶液在 2°C 、pH 7 的环境下下能稳定储存156 天,其粒径和siRNA包封率没有明显变化。Suzuki 等人的补充研究表明 siRNA-LNP 能在 4°C 环境下稳定储存1.5。总之,这些数据都表明是mRNA 的不稳定,而不是 LNP 的不稳定,导致了当前mRNA-LNP疫苗的储存条件严苛和保质期短。 Fan等人总结了脂质体和 LNP的稳定性及其质量属性。LNP 可以承受化学和物理不稳定性,化学不稳定性包括 LNP 中易水解和氧化的脂质的降解。脂质氧化可能发生在不饱和脂肪酸部分(Comirnaty 和 mRNA-1273 不存在该问题)和胆固醇,氧化可能是PEG2000 -DMG中PEG基团存在杂质导致的结果。除此之外,氧化性杂质也可能导致包封的mRNA 氧化。脂质例如 DSPC 和可电离的阳离子脂质中的羧酸酯键容易受温度和pH依赖性的水解的影响(图 6)。 LNP 稳定性的另一个关键因素是物理稳定性,主要有三种类型的物理不稳定性:包封的药物的聚集、融合和泄漏。 LNP 在储存和流通过程中容易发生 LNP 的聚集,所以为了增加稳定性,LNP 中通常添加PEG化脂质,LNP微粒表面的PEG 分子可防止LNP 聚集。 另一种类型的物理不稳定性主要由于mRNA 的泄漏,这主要影响包封产品的稳定性。值得注意的是,包封率通常 > 90%,并且尚未报道过在储存期间出现mRNA泄露(用RiboGreen监测)的情况。未包封的mRNA(“裸露的mRNA”)几乎不会被细胞摄取;而且它会迅速被降解,因此无法用于翻译。 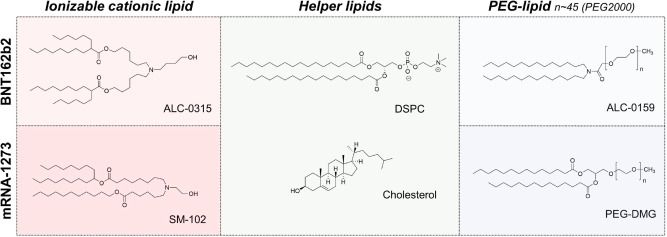 图6 用于 mRNA-LNP疫苗BNT162b2 (Comirnaty) 和 mRNA-1273的脂质。 由于注射 mRNA-LNP疫苗时的超敏反应可能与PEG化脂质有关,因此,已经研究了防止聚集体形成的替代脂质。使用多聚肌氨酸修饰脂质能使脂质递送系统更加稳定,在防止LNP聚集的同时能够减少超敏反应。但是目前仍然需要更多的实验来确定这种 PEG化脂质替代品是否能真正的提高 mRNA 的稳定性(例如不含过氧化物,注:目前使用的PEG脂质由于工艺原因,会有一定的过氧化物杂质,这会引起LNP中其他含有不饱和键的脂质和mRNA的氧化降解)。 分析 LNP 稳定性 Fan 等人在前面提到的文章中对监测 LNP 稳定性的分析方法进行了专业评估。我们推荐感兴趣的读者可以查看相关文献。 mRNA-LNP中哪个成分更不稳定? 迄今为止,已有几项研究考察了在储存期间稳定 mRNA 和稳定 LNP 的方法。然而,两者之中哪一个才是mRNA-LNP稳定性的瓶颈?当mRNA-LNP 制剂未冷冻时,是mRNA 降解?还是 LNP 降解导致稳定性问题?还是 mRNA 与 LNP 的组合? 与mRNA-LNP 系统相比,包封化学修饰且高度稳定的siRNA 分子(例如 Onpattro)的LNP系统具有更长的有效期。这表明当前的稳定性瓶颈不是 LNP,而是 mRNA。 迄今为止,公开资料还没有披露关于 mRNA-LNP 制剂中 mRNA 和 LNP 完整性的研究报告。在研究存储效果的少数研究中,例如 Zhang等人的研究,并没有考察长期储存的稳定性。因此,我们将首先研究裸露的mRNA的长期稳定性,但需要注意的是,这可能与包封在 LNP中的 mRNA 的稳定性有所不同(见下文)。 在Pascolo等人的综述中,裸露的mRNA的水溶液在无RNase的情况下只能在4°C下储存几天。这似乎符合目前对 mRNA 不稳定性的看法。目前关于裸露的mRNA长期稳定性的研究表明,mRNA 需要冷冻或干燥才能保持更长时间的稳定。 Roesler等人2009年的研究表明,编码荧光素酶的mRNA 在无RNA酶存在的条件下,分别以液体或冻干形式在室温下储存,表达效率分别在第8天和第16天开始出现降低,冻干辅料和冻干工艺方面未经优化(见图 7)。同时本研究无法得出关于2-8℃温度下长期储存稳定性的结论,因为稳定性研究只考察了32 天。 Wayment-Steele等人经过基于理论降解速率计算,预测 长度为4000 nt的mRNA在 pH 7.4 和5 °C 的条件下,存储的半衰期为 941 天。他们注意到较长的mRNA序列,例如SAM,更容易发生水解。由于这是jin基于水解降解动力学的理论计算结果,可能会低估 了mRNA的实际降解速率,例如,当存在痕量RNase时,必须对 mRNA 的稳定性进行更多研究才能知道mRNA实际存储的稳定性情况。
图7 通过转染BHK-21细胞中荧光素酶表达效率分析mRNA在水中的稳定性 这些研究表明,在水溶液中 mRNA 可能不如 LNP 稳定。然而,应该重申的是,这两种成分的稳定性考察结果可能与LNP包封mRNA 的情况不同。如前几节所述,mRNA 与可电离的阳离子脂质、胆固醇和水一起位于 LNP 核内部(参见图 4)。这意味着 mRNA 处于水性环境中,因此容易发生水解,其水解的机制可能与溶液中 mRNA水解 的机制相似。然而,另一方面,LNP 内的 mRNA 可能通过疏水、氢键和/或静电相互作用被可电离的脂质包裹。在这种情况下,mRNA 可能比溶解在水溶液中的裸露的mRNA更稳定。在没有进一步研究的情况下,只能得出结论,mRNA 的不稳定性导致了储存条件苛刻。 储存条件不同的原因 当前 mRNA 疫苗的另一个有趣方面是,不同厂家疫苗报告的储存温度和相应的“有效期”差异很大:从 -80°C 到 2-8°C,从几天到几个月。是否因为mRNA 疫苗处的不同导致这种储存条件的差异?又或者,储存条件的差异是否与热稳定性测试结果相关或更可靠的方法有关?这些信息很重要,因为深入了解对稳定性产生积极影响的因素可能是未来设计热稳定mRNA 疫苗的关键突破点。 Acuitas Therapeutics的首席执行官Tom Madden 曾经在采访中表示,Moderna 和 Pfizer/BioNTech mRNA 疫苗可能具有相同的稳定性。后者是否有可能使用更保守的方法来确保稳定性?尽管如此,目前必须在 -60 至 -80 °C 之间储存的Pfizer/BioNTech mRNA-LNP 疫苗很可能也在更高的温度和冷藏条件下进行了稳定性考察,正如CureVac 科学家所做的那样。 此外,稳定性测试中的分析技术在灵敏度上可能不同,验收标准也可能不同。疫苗稳定性研究报告的发布可能对这些疑问作出回答,对此进行比较研究会是很有趣的工作。 本文来自:AVT | 产品分类
重点推荐产品
|
 |