产品介绍 去垢剂兼容型Bradford试剂盒 Detergent-Compatible Bradford Assay Kit
货号:PD-Cde-1000 组分:1000毫升染色液一瓶,5 mg/ml BSA四支。 保存:4度避光,一年有效。-20度冷冻可长期保存。
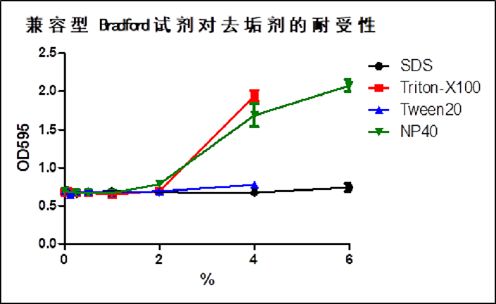
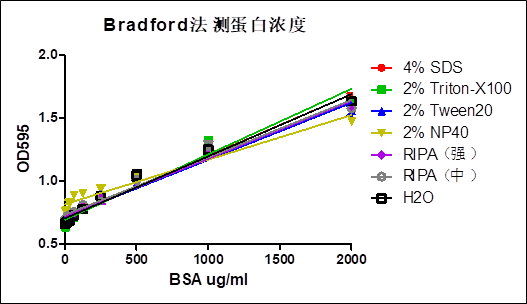
在涉及蛋白组学的实验中,经常需要检测溶液中的蛋白质浓度。常用的蛋白定量的方法分为两大类:一类是铜还原法,原理是在碱性环境中利用肽键将二价铜还原为一价铜,间接反映蛋白质的数量,如双缩脲反应、改良Lowry法、BCA法等;另一类是染料结合法,原理是通过染料与蛋白质的结合,使溶液的光吸收峰发生改变,从而反应蛋白质的数量,最常用的染料是考马斯亮蓝G250(Bradford法),以及一些金属-染料复合物,如儿茶酚-钼酸复合物、邻苯三酚红-钼酸复合物等。 在蛋白质提取和蛋白电泳实验中,经常会用到还原剂和去垢剂(表面活性剂),上述蛋白定量方法往往与这些还原剂和去垢剂不兼容:还原剂对铜还原法有强烈干扰作用,即使在没有蛋白的情况下也能产生显色反应,无论是样品本身含有的抗坏血酸,或是缓冲液中含有的巯基乙醇、二硫苏糖醇(DTT)等,均能形成干扰;去垢剂则对染料结合法有强烈干扰作用,如SDS、Triton X100、Tween-20等,会与染料结合使溶液光吸收峰发生改变;高浓度的去垢剂也会对铜还原法产生干扰,但是在常用浓度下一般没有影响。这些还原剂和去垢剂在蛋白提取缓冲液和电泳相关缓冲液中很常见,传统上解决这些干扰的方法是通过蛋白沉淀法去除干扰成分,然后重悬蛋白进行浓度测定,其缺点在于显著增大了工作量,并且增加了实验误差。 Bradford法不受绝大部分样品中的化学物质的影响,也不受还原剂的影响,但是去垢剂可以造成强烈干扰。通过与染料结合,去垢剂抬高背景光吸收值,使得检测灵敏度和检测范围发生改变,甚至无法检测。本产品通过对Bradford法的改进,采用特殊配方,消除去垢剂的干扰,可兼容6% SDS、4% Tween20、2% Triton-X100、2% NP40,可耐受各种RIPA裂解液,对蛋白组学实验常用的各种缓冲液均可兼容。 RIPA裂解液是一种传统的细胞组织快速裂解液,根据其裂解液的强度大致可以分为强、中、弱三类。RIPA裂解液(强)的主要去垢剂成分为1%Triton X-100,1% Sodium Deoxycholate,0.1% SDS;RIPA裂解液(中)的主要去垢剂成分为1% NP-40,0.5% Sodium Deoxycholate,0.1% SDS;RIPA裂解液(弱)的主要去垢剂成分为1% NP-40,0.25% Sodium Deoxycholate。即使样品含两倍浓度的RIPA裂解液(强)或RIPA裂解液(中),本产品也可对BSA蛋白进行浓度检测,两倍浓度的RIPA裂解液仅仅引起背景OD值升高约40%。 Bradford法蛋白定量的原理是在酸性环境中,蛋白质结合考马斯亮蓝G250染料,导致染料的最大光吸收峰发生位移,从红棕色形式(最大吸收峰 465nm)转化为蓝色形式(最大吸收峰 610nm)。这两种形式在 595nm 处光吸收差异最大,因此 595nm 是测定考马斯染料-蛋白复合物的蓝色的**波长。由于G250染料在结合蛋白前后的光吸收波谱有重叠,直接使用OD595线性拟合,得到的是一个直径很大的曲线,一般情况下可近似看作直线,在蛋白浓度跨度较大时会对线性拟合造成影响。使用OD595/OD470的比值则可以更好地拟合反应过程,得到的是一条直线,可提高检测灵敏度。本试剂盒对BSA蛋白的最大检测浓度可超过4 mg/ml,最低检测灵敏度为约30ug/ml,以检测样品体积5ul计算,即0.15ug的BSA蛋白。使用Bradford法蛋白定量时,被检测的肽或蛋白质的分子量须大于 3KD,低于此分子量的短肽和氨基酸无法检测。
|
相关产品
|
 |