使用BAT-1检测不同pH环境中氧化铁黄的Zeta电位
2023.07.12 点击529次
Α-FeOOH,呈黄色,被称为氧化铁黄(简称铁黄),铁黄形貌多为针状结构,具有较好的遮盖力、耐光性、耐候性、耐酸碱性以及吸收紫外光线等优点,被广泛的应用于皮革、透明塑料、闪光涂料、油墨、颜料等方面,除此之外在精细陶瓷,催化剂以及生物工程领域也有良好的应用前景。 由于氧化铁黄在177℃以上时,将会失去结合水并转化为氧化铁红,为了提高氧化铁黄的耐热性,通常采用表面改性技术,使氧化铁黄在高温下保持良好的稳定性。不同的改性方法,使氧化铁黄的表面带电性发生改变。 Zeta电位是颗粒表面化学的体现,依赖于颗粒表面的化学组成和周围溶液环境,不同的pH下,体现的Zeta电位不同。环境pH对于Zeta电位的影响是多种因素共同作用的结果,首先,pH的改变影响颗粒表面基团的离解平衡;其次,溶液环境中[H]+和[OH]-离子浓度不同,会影响这两种离子在颗粒表面的吸附效果;最后,滴定过程中加入酸或者碱不但会改变环境的pH还同时改变环境的离子强度。在解释滴定曲线的时候需要综合考虑这些影响因素。
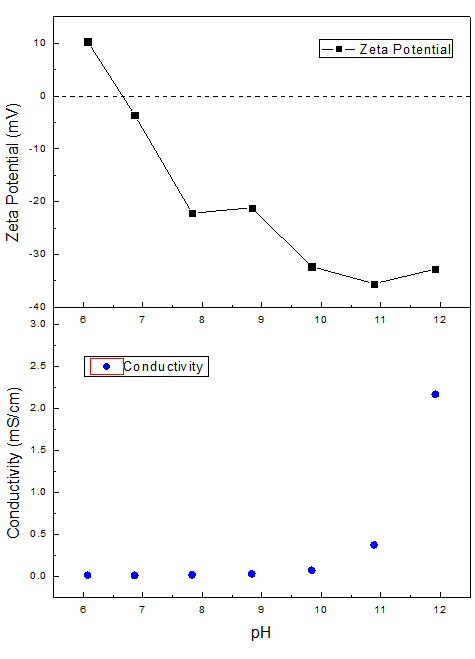
图 | BeNano 180 Zeta Pro与 BAT-1自动滴定仪 样品制备和测试条件 将氧化铁黄粉末分散在纯净水中得到母液,水域超声5分钟使其分散。检测其pH为5.8,初始Zeta电位为正值。通过BeNano主机和BAT-1自动滴定仪进行pH滴定操作,向溶液中滴加NaOH水溶液改变体系的pH。终点pH设定为12,pH间隔为1,冗余度0.2pH值。 通过BeNano内置的温度控制系统开机默认测试温度控制为25℃±0.1℃,采用毛细管电极进行测试。每一个样品在放入样品池后进行一次测试。 测试结果和讨论 通过检测不同pH下样品的Zeta电位值,我们得到Zeta电位随pH的变化曲线。
图 | Zeta电位(上图)和电导率(下图)对于pH的依赖性曲线 从图中可以看出,氧化铁黄样品在低pH范围时Zeta电位为正值,说明其颗粒物上带有较多正电,随着pH升高,Zeta电位逐渐向0趋近,在pH=6.66时达到等电点,此时Zeta电位值为0。随着pH继续升高,[OH]-浓度升高,颗粒开始携带负电荷,其Zeta电位随pH升高绝对值逐渐增大。 相对较高的pH(10~12)范围(颗粒携带较多负电)悬浮液的Zeta电位绝对值比较高,说明体系在此范围内相对比较稳定,不容易团聚,而在等电点附近Zeta电位较低,体系的稳定性相对较差。 当pH达到11之后,颗粒表面的负电荷基本达到饱和,即使pH继续升高,颗粒表面也无法携带更多负电荷。此时继续加入NaOH溶液在pH升高的同时,离子强度也逐渐升高。在颗粒表面电荷基本饱和的情况下,Zeta电位绝对值不再变高,而且随离子强度加大,电导率迅速上升,屏蔽效应逐渐增加,Zeta电位绝对值有缓缓变小的趋势。 结论 通过百特BeNano纳米粒度及Zeta电位仪和BAT-1自动滴定仪表征了一个氧化铁黄样品在不同pH条件下的Zeta电位信息。结果表明,氧化铁黄在pH=6.66时,为其体系的等电点,在等电点附近Zeta电位绝对值相对较低,体系处于不稳定状态。而当较高(pH=10~12)时其体系的Zeta电位绝对值较高,处于相对稳定状态。 | 产品分类
|
 |