糖尿病是一种威胁人类健康的慢性代谢性疾病。目前,临床上针对Ⅰ型糖尿病及Ⅱ型糖尿病中晚期患者的主要治疗方式是频繁皮下注射胰岛素,这给患者造成了痛苦与不便,并会导致外周高胰岛素血症,从而引起低血糖、肥胖等副作用。相较而言,口服胰岛素因无痛、给药方便等特点而更易被患者接受。然而,一方面,人体胃肠道内的生理屏障限制了胰岛素的口服吸收效率;另一方面,胰岛素经口服吸收入血后,面临着在靶部位有效蓄积的困境。正常生理状态下,胰岛素经胰岛β细胞分泌后主要作用于肝脏,且肝脏处胰岛素浓度约为外周组织的2-3倍。口服胰岛素需要依次高效克服肠黏膜吸收屏障并靶向富集在肝脏发挥作用,从而模拟内源性胰岛素的分泌模式,改善体内葡萄糖的利用与分布。因此,胰岛素口服递送面临挑战。
11月4日,受到病毒独特的表面特性及功能特征的启发,中国科学院上海药物研究所甘勇团队联合复旦大学魏刚团队,在《自然-通讯》(Nature Communications)上,在线发表了相关研究成果。该研究设计了一种表面配体可转换的病毒仿生型多功能纳米载体(Pep/Gal-PNP)。经口服给药后,在酸性的胃肠道环境中,Pep/Gal-PNP表面的Pep配体可以仿照包膜病毒表面的刺突蛋白,结构发生伸展并暴露出一端的穿膜肽片段,介导纳米载体高效跨过肠黏膜屏障;入血后,在生理pH条件下,Pep配体结构折叠,Pep/Gal-PNP表面的Gal配体暴露出来、并与肝细胞表面的去唾液酸糖蛋白受体(ASGPR)结合,从而将胰岛素特异性递送至肝脏发挥作用(图1)。体内研究结果表明,Pep/Gal-PNP口服给药后在小肠绒毛上吸收明显,且主要分布在肝脏(约占总吸收量的71.9%)。在I型糖尿病大鼠模型中,Pep/Gal-PNP显示了良好的降血糖效果。更重要的是,Pep/Gal-PNP恢复了糖尿病大鼠体内肝脏-外周的高胰岛素浓度梯度,同时,长期给药后显著提高了肝糖原的储存,约为对照组的7.2倍,有效改善了糖利用。该研究提出了新型的口服胰岛素递送策略,即通过模拟病毒表面蛋白的构象变化,可依次高效克服肠黏膜屏障并精准靶向肝脏,实现糖尿病病理状态下体内血糖的合理处置,有助于维持血糖稳态,并改善胰岛素的口服治疗效果。
研究工作得到国家自然科学基金和复旦大学-上海药物所融合基金的支持。
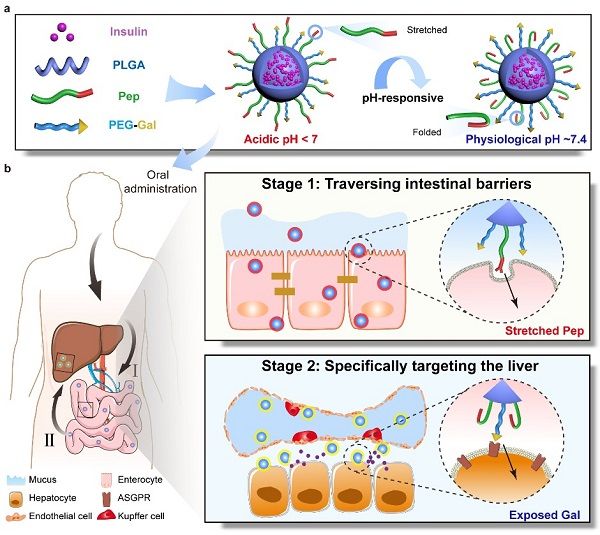
表面配体可转换的病毒仿生型纳米载体的构建及体内递送过程