自噬是指通过形成双层膜结构的自噬体,包裹部分胞质并运送到溶酶体进行降解及回收的过程,对抵抗各种应激和维持细胞稳态至关重要。自噬异与老年痴呆等神经退行性疾病的发生发展密切相关。自噬体形成的关键步骤包括隔离膜(自噬体前体)的启始、成核、延伸及闭合。科学家对自噬体形成的分子机制的了解主要来自对单细胞酵母自噬的研究。多细胞生物自噬体的形成过程更加复杂,包括多个独特的步骤以及多细胞生物特有的自噬蛋白的参与。
多细胞生物自噬与酵母自噬的重要区别之一在于自噬体形成的位置。酵母自噬体在液泡膜上形成,而多细胞生物自噬体在内质网的多个位点同时形成。鉴定决定自噬体在内质网上形成的信号是自噬领域悬而未决的科学问题。
10月5日,中国科学院生物物理研究所研究员张宏课题组在《细胞》(Cell)上,在线发表了题为Calcium transients on the ER surface trigger liquid-liquid phase separation of FIP200 to specify autophagosome initiation sites的研究论文。该研究发现自噬诱导条件下引起的内质网表面的钙瞬变是决定自噬体在内质网上形成的关键信号。内质网表面的钙瞬变引起参与自噬起始的FIP200复合物发生液-液相分离;形成的FIP200凝聚体进而与内质网膜蛋白VAPs和ATLs结合定位于内质网,成为自噬体起始位点。
研究显示,钙离子快速螯合剂BAPTA-AM可以抑制参与自噬起始的FIP200复合物在内质网上形成凝聚体,但这一过程不能被慢速钙离子螯合剂EGTA-AM阻断。这提示快速的局部的钙离子变化而非稳态的钙离子浓度变化,可能参与自噬起始过程。科研人员构建了内质网跨膜结构域CYB5与快速钙离子探针GCaMP6f的融合蛋白,将GCaMP6f定位于内质网膜表面朝向胞浆侧,以检测自噬诱导下内质网膜表面钙离子浓度的变化。研究利用多模态超分辨活细胞成像技术(Multi-SIM)发现,在饥饿或Torin1处理等自噬诱导条件下,内质网表面发生钙瞬变/钙振荡,而这些钙信号能被BAPTA-AM阻断却不能被EGTA-AM阻断。
研究发现抑制内质网表面钙瞬变/钙振荡会阻碍自噬体形成。钙离子通道释放抑制剂以及钙通道蛋白敲低的细胞中,自噬起始FIP200复合物在内质网上形成凝聚体被显著抑制,这表明内质网表面钙瞬变对自噬体的形成颇为重要。自噬诱导条件下,内质网表面的钙瞬变/钙振荡是被精细调控的。在钙离子通道激活剂处理下,内质网表面的钙瞬变/钙振荡的幅值、频率和持续时间显著增加。FIP200凝聚体以及WIPI2等标记的早期自噬结构的数目显著增加,但自噬流活性却被抑制,这表明钙离子通道激活剂的处理抑制有功能性的自噬体结构的形成。电镜观测发现,这些自噬结构显著变小且不能闭合,提示内质网表面钙的持续增高影响自噬体的延伸及闭合过程。
张宏课题组前期利用建立的线虫遗传筛选模型鉴定了一系列多细胞生物特有自噬基因,包括编码内质网跨膜蛋白的epg-4/EI24。本研究发现敲除EI24的细胞,表现出与钙离子通道激活剂处理类似的现象,内质网表面出现持续的钙振荡,并表现出类似的自噬缺陷。研究通过化学试剂处理,或敲低内质网表面钙通道的活性,可以降低EI24敲除引起的钙瞬变,并拯救其自噬缺陷的表型。EI24可以与多种内质网钙通道和钙泵结合。这提示EI24可以通过调节内质网钙通道和钙泵的活性,进而调控内质网表面钙瞬变的幅度、频率和持续时间。
内质网表面钙瞬变/钙振荡是如何决定参与自噬起始的FIP200复合物在内质网上组装?研究发现,自噬诱导条件下,内质网表面发生的钙瞬变/钙振荡触发FIP200复合物发生液-液相分离,形成具有高度动态且易于融合的液滴状FIP200凝聚体。FIP200凝聚体通过与内质网膜蛋白VAPs和ATLs结合,稳定定位于内质网上,并沿着内质网移动,与其他FIP200凝聚体融合。在达到一定大小后,FIP200凝聚体停止融合,成为内质网上的自噬体起始位点,招募下游自噬蛋白,启动自噬体的形成。该研究揭示了内质网表面钙瞬变是决定自噬体在内质网上形成的关键信号,促进了科学家对多细胞生物自噬分子机制的理解,并对探究自噬异常与相关疾病的发生发展以及开发新的治疗策略有重要意义。
研究工作得到国家自然科学基金、国家重点研发计划的资助,并获得生物物理所成像平台的技术支持。
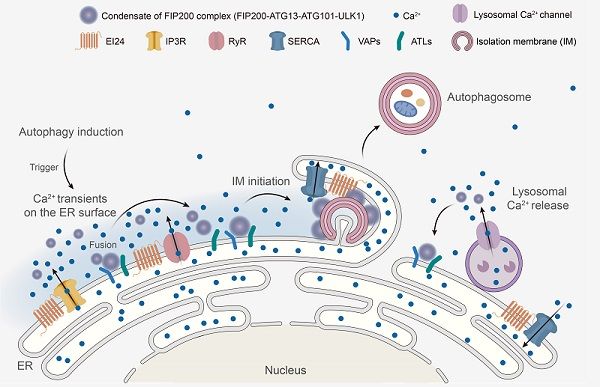
内质网外膜钙瞬变触发FIP200复合物发生液-液相分离,并形成内质网上自噬起始位点的模式图