一个受精卵发育为一个复杂个体,正常体细胞变成肿瘤细胞,细胞作为生命的基本单位,其状态的动态变化既是健康发育的基础也是疾病产生的原因。从光学显微镜对细胞形态变化的观察,到绿色荧光蛋白对细胞基因、表达定位等变化的追踪,再到分子记录器在基因组中稳定写入曾经发生的分子事件,以及单细胞转录组测序的发展,允许细胞全转录组的变化拟时序推测,每一次细胞动态变化记录的技术变革均推动了细胞生物学的发展。既有方法或受限于对细胞形态或少数基因的动态表征,或依赖于拟时序分析中多种在实际细胞体系中可能无法满足的假设,目前尚不能直接测量细胞全转录组状态变化。
8月17日,中国科学院深圳先进技术研究院、瑞士洛桑联邦理工学院Bart Deplancke课题组、苏黎世联邦理工学院Julia Vorholt课题组合作,在《自然》(Nature)上以article长文形式,发表了题为Live-seq enables temporal transcriptomic recording of single cells的研究论文。
该研究开发了活细胞转录组测序技术(Live-seq),首次实现了单细胞进行转录组测序后依然能够保持细胞存活。该技术兼具全基因表达分辨率和动态解析能力,是当前对单细胞转录组直接动态测量、偶联细胞现有状态及其后续表型的唯一解决方案。
基因表达程序的变化是细胞对外源和内源刺激反应的重要表现。对单个细胞的连续观测是细胞对刺激反应、变化的重要研究手段,活细胞成像是最早的方法之一。随着显微成像技术和荧光标记手段的发展,显微成像可实现从体外细胞培养到体内环境下对基因表达的动态观测。基因编辑技术的发展促进分子记录器的出现。该技术通过细胞原生的或人工合成的基因线路,对刺激的感应并将信息写入基因组,记录历史分子事件。技术的发展和应用促进细胞生物学的发展,例如活细胞成像已成为现代细胞生物学实验室的常用手段;分子记录器虽出现不久,但在体内多场景的适用性和稳定性上颇具潜力。而它们在记录基因表达上存在共同的限制——在一个细胞中只能同时记录一个或几个基因的表达。
2009年汤富酬首创单细胞mRNA测序以来,不再只依靠少数几个基因的表达来分析细胞类型,而可用整个转录组的状态来更系统全面的定义细胞类型和状态。单细胞转录组变革了对细胞状态异质性的解析能力,推动了发育生物学、肿瘤细胞学、免疫学和干细胞生物学等的发展。然而,研究只可测量细胞的静态状态,无法像前述的活细胞成像那样连续观测细胞的动态或检查细胞后续的表型。为了克服这一限制,多种基于计算或标记的方法被开发出来。这些方法基于共同的假设,即群体的静态分布可以模拟个体的动态运动。运用不同的数学模型和/或新旧RNA的标记等手段,研究将转录组相似的细胞连接,产生一条轨迹来代表一个细胞的变化路径。这些方法提供了有意义的生物学认知,但由于这些前提假设在复杂细胞系统不一定能被满足,其提供的变化路径应被解读为一种统计学上的预期,而非细胞真正变化的轨迹。而这些限制的根本原因在于单细胞测序时裂解杀死了细胞,因而无法连续测量。
本研究中,科研人员开发出活细胞转录组测序技术(Live-seq),在进行单细胞转录组测序后,依旧保持细胞的存活和功能。该技术的核心是对部分细胞质进行微创地提取,并对微量的细胞质RNA进行扩增。具体地,该技术整合改造了多种跨学科技术(图1):具备纳米级移动分辨率和皮牛顿力学灵敏度的原子力显微镜,实现超精密显微操作;亚皮升级别的微/纳流控通道和液压调节系统,实现微量(约1皮升)样品提取和转移;纳米级的、中空可定量的、可和细胞膜无缝密封的特殊探针,可实现微创的细胞质提取;相偶联的实时跟踪成像和细胞培养系统,可以长时间锁定同一个细胞;高灵敏度的RNA扩增测序;对前述步骤的无缝整合。
Live-seq只对少量的细胞质进行测序,其结果能否代表细胞的状态?研究对多种类型和状态的细胞进行活细胞测序,并平行地和单细胞测序结果进行比较。结果显示活细胞测序结果和单细胞测序结果高度吻合,证明了Live-seq能够较好的体现细胞的全转录组状态。这一过程是否改变细胞状态甚至杀死细胞?研究对包括干细胞在内的多种细胞类型进行评估,发现大部分细胞在Live-seq后仍然存活。同时,细胞分裂依然能够正常进行(图2)。研究通过对巨噬细胞对细菌脂多糖LPS刺激的反应和脂肪干细胞分化过程的观测发现,细胞的反应未因Live-seq而有明显变化。研究对接受和未接受细胞质提取的细胞全转录组进行比较,也未发现大量的基因表达变化。结果显示,Live-seq未对细胞的活性和功能产生较大影响。
由于细胞测试后仍旧存活,Live-seq首次实现对同一个细胞全基因表达的连续测量。作为概念验证,Live-seq直接测定了同一个巨噬细胞和脂肪干细胞在刺激前后的变化路径(图3)。Live-seq可以回答细胞怎样的过去决定它的现在。即使是单克隆来源的巨噬细胞对细菌脂多糖的反应依旧有很大的异质性。利用这一模型,研究表明起始状态的少数基因的表达差异和噪音(如Nfkbia、Gsn等)是决定细胞后续反应差异的重要原因,处于细S期的细胞对刺激反应也更弱。对应地,普通的单细胞转录组无法找到这些规律。
Live-seq仍有不足:与高通量的单细胞转录组相比,Live-seq是低通量的手段;Live-seq尚不能在体内应用;在高度极化而mRNA分布不均的细胞(如神经细胞)中,Live-seq或无法体现全细胞转录组;多次采样对细胞的干扰需要更多研究。未来持续的发展如自动化提高通量、通过和双光子显微镜联用运用于体内样品等,有望使上述不足得到改善。Live-seq第一次使得对活细胞的连续观测成为可能,希望可以催生更多新可能。
研究工作得到国家重点研发计划、深圳合成生物创新研究院的支持。
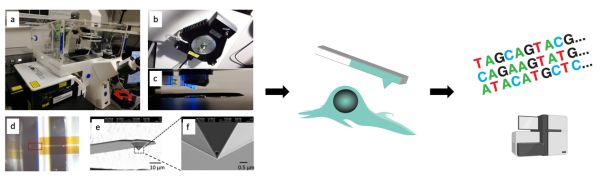
图1.Live-seq基本原理
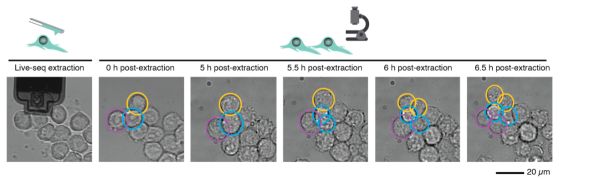
图2.Live-seq对细胞的影响,黄色的细胞被提取出细胞质,蓝色和紫色的细胞未被处理
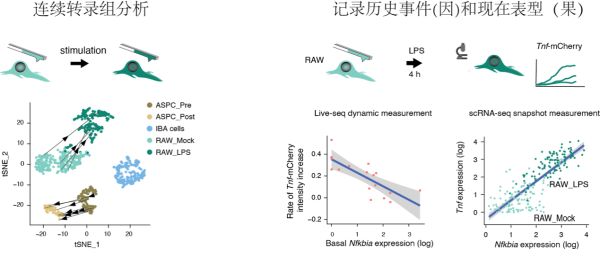
图3.活细胞测序新可能:(左图)对同一个细胞转录组的连续分析;(右图)偶联细胞起始的转录组状态(因)和后续细胞对刺激的反应(果)