一、实验目的
1、了解补偿法原理:掌握电势差计的使用;
2、测定下列三组电池的电动势:
A) Zn | ZnSO4 ( b = 0.1mol·kg-1 ) || CuSO4 ( b = 0.1mol·kg-1 ) | Cu
B) Zn | ZnSO4 ( b = 0.1mol·kg-1 ) || KCl (饱和 ), Hg2Cl2 (s) | Hg
C) Hg | Hg2Cl2 (s), KCl (饱和 ) || HCl (b = 0.1mol·kg-1 ),氢醌 | Pt
二、实验原理 (补偿法原理 )
电化学中关心的是可逆电池的电动势,因而要求测量过程中通过的电流无限小,补偿法就是通过在外电路上加上一个大小相等,方向相反的电势差与原电池相抗衡,达到测量回路中电流 I →0的目的。其线路示意图见图 1。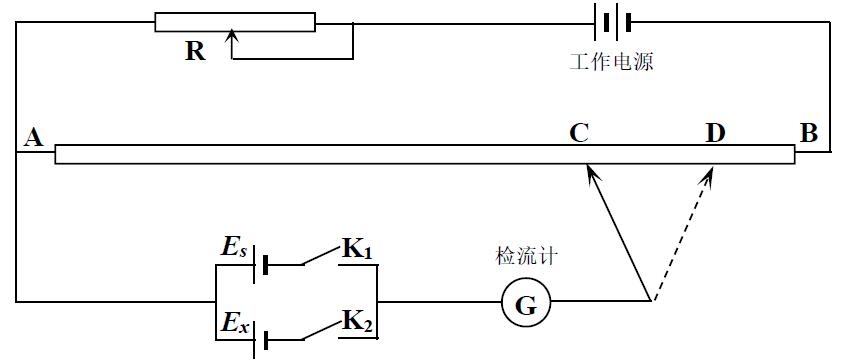
图 1 补偿法原理图
测电动势用的仪器称为电位差计,其主要部件为阻值精确且均匀电阻, (图 1中的 AB段)。
测量时接通 K2,即将待测电池 Ex接入电路,然后移动接头,若移至 C处时检流计 G上显示电流 I→0则表明 AC段上的压降等于待测电池 Ex的电动势,由仪器可读出其电势差的数值 .但电势差的数值不仅决定于电阻,而且与流经电路的电流大小有关,而仪器使用时实际的电流大小是不定的,这样对仪器刻度数值的可靠性就带来了问题。为此电位差计在测量 Ex前必须对其读数进行校准——仪器标准化。进行仪器标准化时接通 K1,即将标准电势差 (Es=1.0000V)接入电路,移动接头至 D处,然后调节可变电阻 R至检零指示 G上显示电流 I→0,表明 AD段上的压降等于标准电势差 Es,即仪器的标准化是调节电流,或者说是校正仪器读数 .
三、仪器与试剂
3.1 仪器
SDC-Ⅱ数字电位差综合测试仪;甘汞电极,铂电极,铜电极,锌电极各一支;金相砂纸;U形玻璃管;100 mL烧杯 4个。
3.2 试剂
0.1 mol·kg-1 CuSO4;0.1 mol·kg-1 ZnSO4;0.1 mol·kg-1 HCl;饱和 KCl;琼脂。
四、实验步骤
4.1 制作盐桥
取琼脂 3 g,饱和 KCl 100 mL加热至完全溶解,趁热将此溶液装入 U形玻璃管中,静置固化后即可使用。
4.2 处理Cu、Zn电极:先用金相砂纸除去电极表面的氧化物,用蒸馏水冲洗檫干,并用纸吸干备用。
4.3 仪器标准化
(1) 打开仪器开关,将测量选择旋钮旋至“内标”
(2) 调节电位旋钮至电位指示为: 1.00000 V
(3) 按“采零”键至检零指示为: 0.000 V
4.4 测量电池电动势 E
(1) 取100mL烧杯 2个,分别装入半杯 0.1 mol·kg-1 CuSO4和 0.1 mol·kg-1 ZnSO4,分别插入Cu电极和Zn电极,中间架以盐桥,即构成铜─锌电池。
(2) 将电池接入测量端;将测量选择旋钮旋至 “测量”
(3) 由大到小依次调节电位旋钮至检零指示为 0.000时记录电位指示的读数即为待测电池的电动势。
(4) 重复上述4.3,4.4步骤,记录第二次数据
(5) 更换电极重复以上操作测量另两个电池的电动势。
其中甘汞电极──KCl(饱和), Hg2Cl2(s) | Hg,将甘汞电极置于饱和 KCl溶液中即可;
其中氢醌电极──HCl(b = 0.1 mol·kg-1),氢醌 | Pt,将铂电极置于溶有少量氢醌的 HCl(b = 0.1 mol·kg-1)溶液中即可。
¤ 实验完毕拆除线路;将饱和甘汞电极放回饱和KCl溶液中保存;实验用KCl倒入回收瓶,清洗电极和烧杯,整理仪器及桌面。
五、实验数据处理
5.1 计算各电极的电极电势 E(电极)。
⑴ 锌电极
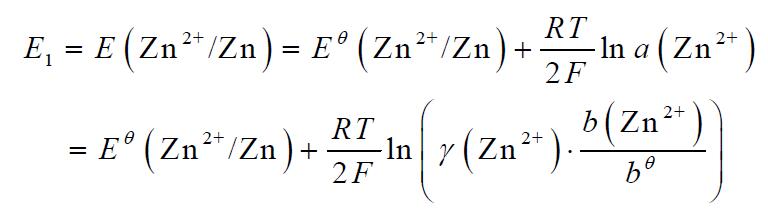
⑵ 铜电极
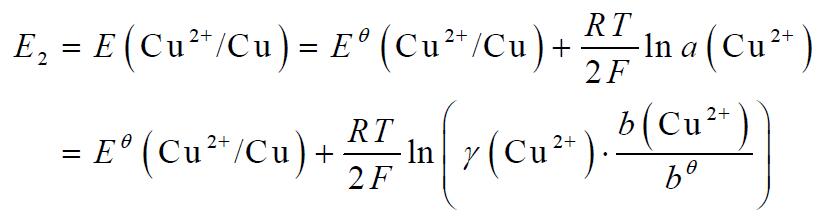
式中 : bθ = 1 mol·kg-1
γ (Zn2+) ≈ γ(ZnSO4) 及 γ (Cu2+) ≈ γ(CuSO4)
可查《物理化学》下册 P.16表 7.4.1
⑶ 甘汞电极
参见《物理化学》下册 P.35
E(饱和甘汞)=(0.2410-7.6×10-4 (t/℃-25)) V
⑷ 醌氢醌电极
参见《物理化学》下册 P.36 ~ 37
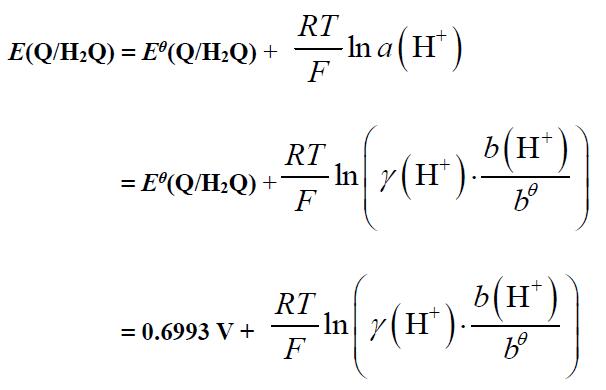
式中:γ(H+) ≈ γ(HCl)可查《物理化学》下册 P.16表 7.4.1
5.2 计算各电池的电动势 : E=E+-E-
5.3 计算实验数据的相对误差
| 电池 | E实验 / V | E理论 / V | △E / E理论 |
| A | |||
| B | |||
| C |